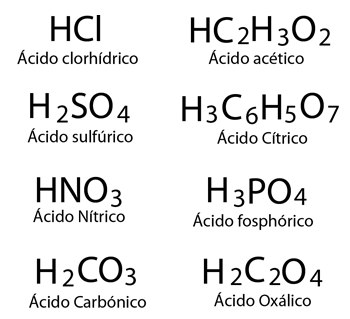
Ácidos
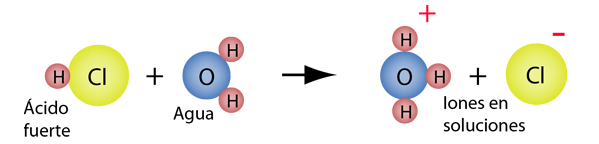
A principios de la historia de la química se observaron ciertas propiedades de ácido. De acuerdo con el concepto de ácido-base de Arrhenius, una sustancia se clasifica como ácido si se ioniza para formar iones de hidrógeno H(+) en solución acuosa. Por ejemplo, el ácido clorhídrico reacciona con el agua para formar iones de hidrógeno que se transfieren a una molécula de agua para formar un ion hidronio.
Otros sistemas clasifican las sustancias como ácidos, si actúan como donantes de protones (teoría de Bronsted-Lowry), o como aceptores de pares de electrones (teoría de Lewis). Estos dos métodos de clasificación no se limitan a soluciones en agua.
| Ácidos Comunes | Concepto de pH |
| Compuestos Inorgánicos |
Conceptos de Ácido
Conceptos de Química
| HyperPhysics*****Química | M Olmo R Nave |