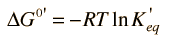Energía Libre de Gibbs y Espontaneidad de las Reacciones Químicas
El cambio en la energía libre de Gibbs asociado con una reacción química, es un indicador útil de si la reacción se producirá espontáneamente. Dado que el cambio en la energía libre es igual al trabajo útil máximo que se puede lograr por la reacción
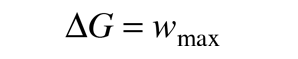
entonces, un ΔG negativo asociado con una reacción, indica que esta puede ocurrir de forma espontánea. Esto es coherente con la convención química habitual del tratamiento del trabajo realizado por el sistema como un trabajo negativo. Las reacciones más comunes pueden ser evaluadas para su espontaneidad bajo condiciones normales, buscando las cantidades termodinámicas asociadas a cada uno de los reactivos y los productos. Para condiciones no estándares se puede hacer uso de la expresión del ΔG en términos de los otros potenciales termodinámicos
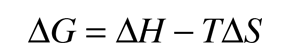
El cambio en la energía libre ΔG de una reacción, se puede expresar en términos de las concentraciones de equilibrio de los reactivos y productos. Es conveniente expresar ΔG para cualquier reacción, en términos de su valor bajo condiciones estándares en las que se han tabulado los valores. Para una reacción representada como
el cambio en la energía libre se puede expresar como
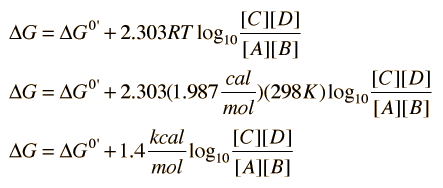
Donde ΔG0' es la variación de energía libre estándar y se presume a la temperatura de 25°C = 298K.
| Ejemplo de Hidrólisis de ATP |
Conceptos de Electroquímica
Referencias
Ebbing
Cap. 18
Karp
Cap. 3
| HyperPhysics*****Electricidad y Magnetismo*****Química | M Olmo R Nave |