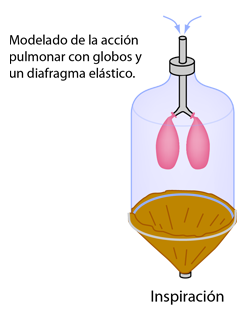
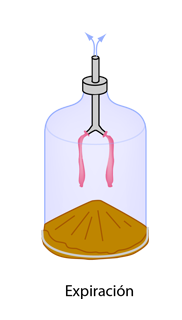
Ley de Graham
Cuando los gases se disuelven en un líquido, la tasa relativa de difusión de un determinado gas es proporcional a su solubilidad en el líquido, e inversamente proporcional a la raiz cuadrada de su masa molecular. La tasa de difusión relativa del dióxido de carbono y del oxígeno en el plasma del cuerpo humana, son importantes en el transporte de los gases de la respiración. El dióxido de carbono tiene 22 veces la solubilidad del oxígeno, pero es mas masivo (44 uma comparado con 32 uma del oxígeno). De acurdo con la ley de Graham la tasa de difusión relativa está dada por
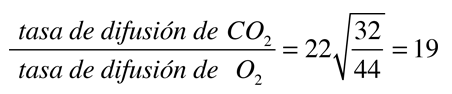
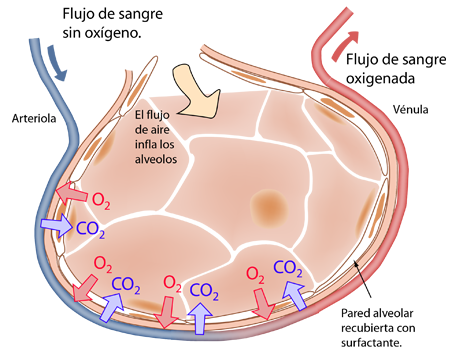 | La ley de Graham se puede aplicar al proceso que ocurre en los alvéolos de los pulmones. |
| Difusión | Ósmosis | Transporte de Membrana | Ley de Henry | Ley de Fick |
Conceptos sobre Teoría Cinética
Aplicaciones de Teoría Cinética
| HyperPhysics*****Termodinámica | M Olmo R Nave |