La Corrosión como Proceso Electroquímico
Un trozo de hierro puro fuera del alojamiento cerrado donde se encuentra, se expone a la humedad y se oxida rápidamente. Lo hará de forma más rápida si la humedad es por agua salada. La velocidad de corrosión se ve reforzada por un proceso electroquímico en el que una gota de agua se convierte en una célula voltaica en contacto con el metal, oxidando el hierro.
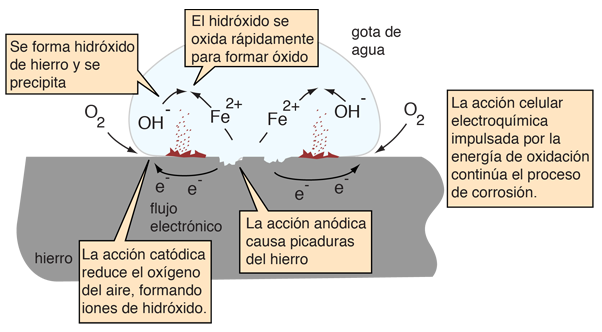
Considerando el dibujo de una gota de agua (de Ebbing), el hierro oxidante suministra electrones en el borde de la gota para reducir el oxígeno del aire. La superficie de hierro dentro de la gota actúa como el ánodo del proceso
Fe(s) -> + Fe2+(aq) + 2e-
Los electrones pueden moverse a través del hierro metálico hacia la parte exterior de la gota, donde
O2(g) + 2H2O(l) + 4e- -> 4OH-(aq)
Dentro de la gota, los iones de hidróxido se pueden mover hacia el interior para reaccionar con los iones de hierro(II) que se mueven desde la región de oxidación. Se precipita hidróxido de hierro(II).
Fe2+(aq) + 2OH-(aq) -> Fe(OH)2(s)
Luego se produce rápidamente la corrosión, por la oxidación del precipitado.
4Fe(OH)2(s) + O2(g) -> 2Fe2O3 •H2O(s) + 2H2O(l)
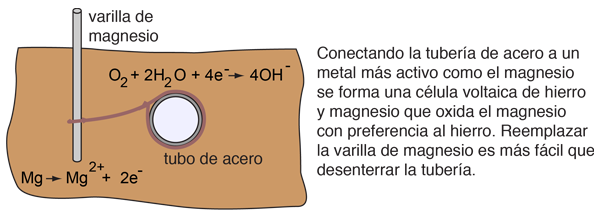
La oxidación del hierro sin protección en presencia de aire y agua es entonces inevitable, ya que es impulsada por un proceso electroquímico. Sin embargo, otros procesos electroquímicos pueden ofrecer cierta protección contra la corrosión. Las barras de magnesio pueden ser utilizadas para proteger las tuberías subterráneas de acero, por un proceso llamado protección catódica.
| Protección Catódica Contra la Corrosión |
Conceptos de
Oxidación/Reducción
Conceptos de Electroquímica
Referencia
Hill & Kolb
Cap. 8
Ebbing
Cap. 19
| HyperPhysics*****Electricidad y Magnetismo*****Química | M Olmo R Nave |