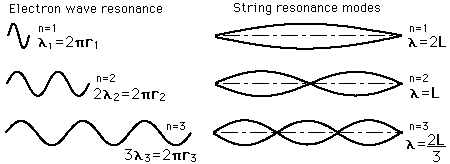El Problema del Espectro de Línea
En los años anteriores al comienzo del siglo 20, se encontró que la luz emitida por los gases luminosos no consistían en un rango continuo de longitudes de onda, sino de colores discretos que eran diferentes para diferentes gases. Estas "líneas espectrales" formaban series regulares, y llegaron a ser interpretadas como transiciones entre niveles energéticos atómicos. Esto representó un problema considerable para la física clásica, porque se sabe que las cargas aceleradas, irradian energía electromagnética. Se esperaba que las órbitas de los electrones alrededor de los núcleos positivos serían inestables, porque estas cargas irradiarían energía y por lo tanto caerían en espiral hacia el núcleo. No se pudo encontrar un modelo clásico, que produjera órbitas estables de electrones.
El modelo de Bohr del átomo, arrancó la progresión hacia una teoría moderna del átomo, con su postulado de que el momento angular está cuantizado, dándole solamente específicas energías permitidas. Luego, el desarrollo de la teoría cuántica y la ecuación de Schrodinger, refinaron el cuadro de los niveles de energía de los electrones atómicos.
|
Índice
Conceptos del Modelo de Bohr |