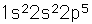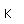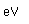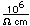Flúor
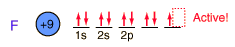
El flúor, el más ligero de los halógenos, es el más reactivo de todos los elementos. Forma compuestos con todos los elementos, excepto los gases nobles.
La reactividad del gas flúor puro es notable. Sustancias ordinarias como madera y goma arden en llamas, cuando se mantiene sobre un chorro de flúor. Incluso el amianto reacciona con tanto vigor que se vuelve incandescente. El cobre y el acero son atacados por él, pero queda recubierto con una fina capa de fluoruro de cobre o fluoruro de hierro, que resiste un ataque adicional. Por lo tanto, los tanques de acero se puede utilizar como contenedores para el transporte de flúor.
El flúor se presenta en la naturaleza en minerales como la fluorita, CaF2, que puede producir cristales de calidad gema. La fluorita se utiliza para la fabricación de acero y es la principal fuente de flúor para la crema dental, el agua fluorada, los refrigerantes y el teflón. También se presenta como un mineral en la fluorapatita, Ca5(PO4)3F, que es un constituyente de los huesos y los dientes. Un pequeño porcentaje de fluorapatita junto con los fosfatos de calcio más abundantes en los dientes, pueden hacerlos más resistentes a las caries. El flúor se encuentra en los minerales de fosfato herderita y montebrasita.
El flúor se encuentra en los minerales de silicato carletonita, lepidolita, flogopita, condrodita, clintonita y fluorapophyllita.
El aluminio con boro y flúor forman el óxido (borato) jeremejevita. El flúor se encuentra con calcio, sodio y tantalio en el mineral de óxido microlita.
El flúor está en el mineral de sulfato creedita y en el fluoruro criolita.
El plomo con el cloro y el flúor forman la matlockita.
El flúor se encuentra con lantano y cerio en el mineral de carbonato parisita.
El fluoruro de hidrógeno, HF, en agua se llama ácido fluorhídrico. En fase de vapor el HF se puede utilizar para el grabado de vidrio. El ácido fluorhídrico se deben manejar con mucho cuidado, ya que el contacto con la piel produce lesiones que sanan muy lentamente. El ácido fluorhídrico se puede almacenar en envases de polietileno.
La reacción con los metales alcalinos produce sales llamadas fluoruros. El fluoruro de sodio, NaF, se utiliza como insecticida.
|