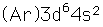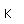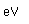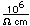Hierro
El hierro puro es un metal de color blanco plateado brillante, que se oxida rápidamente en aire húmedo o con agua que contenga oxígeno disuelto. Es blando, maleable y dúctil, y es fuertemente magnético (ferromagnético).
Es raro encontrarlo en forma elemental en la Tierra, pero la muestra de la derecha se encontró en Groenlandia. También se ha encontrado en rocas ígneas en Rusia.
|
 |
El hierro puro tiene poco uso -algo en química analítica y en medicina-. Se hace mucho más útil mediante aleación con otros materiales.
Añadiendo una pequeña cantidad de carbono al hierro, lo fortalece en gran medida. Otras aleaciones útiles se hacen mediante la adición de metales de transición.
El hierro es uno de los 8 grandes elementos en la corteza terrestre, siendo el cuarto elemento más abundante con alrededor de un 5% en peso. El mineral de hierro es abundante, pero su aislamiento es un proceso que consume intensa energía. Los minerales principales son los óxidos hematita, Fe2O3, y magnetita, Fe3O4, y su carbonato siderita, FeCO3. El hierro también forma los minerales de óxido lepidocrocita y goethita, cada uno con la fórmula general FeO(OH). El hierro se encuentra con manganeso y zinc en el mineral de óxido franklinita.
El hierro se encuentra con el magnesio en el carbonato pyroaurita. La pirita de hierro Fe2S, contiene hierro, pero es difícil aislarlo del azufre. Este mineral se utiliza como fuente de azufre. Una variedad de pirita se llama pirrotita y su composición se escribe Fe1-xS. El hierro también forma el sulfuro marcasita, FeS2. El cobre se une al hierro para formar la calcopirita, CuFeS2. El hierro también se une con arsénico para formar la arsenopirita, FeAsS. El hierro con arsénico forma el mineral loellingita, FeAs2. El hierro forma algunos fosfatos como la vivianita. El titanio y el hierro juntos forman el óxido ilmenita, FeTiO3. El cromo y el hierro juntos forman el óxido cromita, FeCr2O4. El hierro forma un mineral de óxido con titanio, plomo y manganeso llamado senaita. El hierro se une en un sulfuro con cobre y antimonio llamado tetrahedrita. Un sulfuro con antimonio forma el mineral berthierita. Los sulfuros con cobre incluyen la bornita, Cu5FeS4, y la cubanita, CuFe2S3. El sulfuro formado con estaño, plomo y antimonio se llama cilindrita. El hierro se encuentra en el mineral nagyagita, un sulfuro, junto con oro, plomo, antimonio y telurio. La tennantita es un sulfuro que contiene hierro, arsénico, cobre y antimonio. La germanita es un sulfuro que contiene cobre, germanio y hierro. El plomo, el cobre y el hierro se unen en el sulfuro betekhtinita. El cobalto se une con el hierro y el arsénico en el sulfuro glaucodot, (Co,Fe)AsS. El zinc y el hierro forman el sulfuro wurtzita, (Zn,Fe)S.
Un mineral de sulfato de hierro y potasio es la jarosita. La beudantita es un mineral que contiene hierro y plomo junto con grupos sulfato y arseniato, PbFe3(AsO4,SO4)2(OH)6. El hierro junto con el magnesio, es un constituyente de los minerales de silicato fibrosos al que fueron dados colectivamente el nombre comercial de amianto. Estos minerales incluyen la tremolita, la riebeckita y la grunerita. El abundante hierro de la corteza terrestre se encuentra en minerales de silicato tales como la andradita.
La graftonita es un mineral de fosfato de hierro, manganeso y calcio. El hierro aparece con magnesio y aluminio en el fosfato lazulita. El hierro, magnesio y manganeso forman el mineral de fosfato ludlamita. Un fosfato de hierro y aluminio es la paravauxita.
El níquel se encuentra a menudo en asociación con hierro y a veces forma el compuesto Ni3Fe, llamado en su forma mineral awaruita. Los meteoritos de niquel-hierro son bastante comunes.
Las formas útiles comunes de aleaciones de hierro son el hierro fundido, el hierro forjado y el acero.
El hierro forjado está hecho de hierro fundido fundiéndolo sobre un lecho de óxido de hierro. El resultado final es un material que es casi hierro puro, con sólo 0,1-0,2% de carbono, y menos del 0,5% total de impurezas. La purificación se produce porque el lecho de óxido de hierro oxida el carbono pasándolo a monóxido de carbono y a azufre, fósforo y silicio en sus formas de óxidos. Estos óxidos forman parte de la escoria. A medida que el hierro se vuelve más puro, su punto de fusión se eleva y se vuelve pastoso, señalando el momento para sacarlo del horno. La escoria es forzada a salir por martilleo.
El hierro forjado creado por este proceso es fuerte y resistente y se puede soldar y forjar. Muy popular en el pasado, ahora se ha sustituido en gran medida por el acero dulce.
El acero es una aleación purificada de hierro con carbono que se fabrica en estado líquido. El proceso de fabricación elimina casi todo el fósforo, azufre y silicio que existen en el hierro fundido común. La gama de contenido de carbono de los aceros es de 0,1 a 1,5%. Los aceros de bajo carbono (<0.2% carbono) se denominan aceros dulces. Son maleable y dúctil y se utilizan en lugar de hierro forjado. Los aceros medios (0,2 a 0,6% de carbono) se utilizan como acero de estructura (vigas, soportes). Ambos aceros templado y medio pueden ser forjados y soldados.
Los aceros de alto contenido en carbono (0,75 a 1,5% de carbono) se utilizan para la fabricación de herramientas de corte, instrumentos quirúrgicos, taladros y otras herramientas. Los aceros de medio y alto cotenido en carbono pueden ser templados y revenidos.
El hierro es esencial para la vida, está presente en la hemoglobina, la molécula de los glóbulos rojos de la sangre que transporta el oxígeno desde los pulmones a los tejidos del cuerpo. El hierro también está presente en la mioglobina en los músculos. La mioglobina es similar a la hemoglobina y toma de oxígeno de la misma, manteniendo el oxígeno en el músculo hasta que se necesite. En las células hay compuestos que contienen hierro llamados citocromos, que juegan un papel en la oxidación de las moléculas de alimento.
|
Índice
Tabla Periódica
Conceptos de Química
Referencia
Pauling
Cap. 27 |