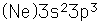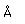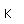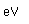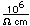Fósforo
El fósforo es un no metal de bajo punto de fusión que se presenta en varias formas. El vapor de fósforo justo por encima de su punto de ebullición de 280,5°C, se compone de moléculas tetratómicas en forma tetraédrica en contraste con su forma diatómica a temperatura más alta, similar a la forma del nitrógeno diatómico. Este vapor tetratómico se condensa en fósforo blanco líquido, el cual se congela a 44,1°C, en fósforo blanco sólido, un material blando y ceroso incoloro. En esta forma sólida, mantiene sus moléculas P4.
El fósforo blanco es metaestable y cambia lentamente a una forma estable, el fósforo rojo, en presencia de luz o por calentamiento. El fósforo rojo es mucho más estable que la forma blanca. No se inflama en el aire a temperaturas inferiores a 240°C, mientras que el fósforo blanco se incendia a 40°C. El fósforo rojo no se puede convertir en fósforo blanco excepto por vaporización del mismo.
El fósforo blanco es muy venenoso, con aproximadamente 0,15 gramos se tiene una dosis letal. Causa necrosis de los huesos, especialmente los de la mandíbula. El fósforo rojo no es venenoso.
El fósforo se presenta en la naturaleza como minerales fosfatados incluyendo la fluorapatita, Ca5(PO4)3F, la hidroxi-apatita, Ca5(PO4)3(OH) y el fosfato tricálcico Ca3(PO4)2. La hidroxiapatita es el constituyente principal de los dientes y los huesos. Los compuestos orgánicos complejos del fósforo son constituyentes esenciales de los tejidos nervioso y cerebral y de muchas proteínas, y están implicados en las reacciones metabólicas de los organismos vivos.
Grandes cantidades de fósforo se convierten en ácido fosfórico.
El fósforo se utiliza en la fabricación de fósforos (cerillas). La antigua práctica de la utilización de fósforo blanco en las cerillas ha sido abandonada debido a la naturaleza extremadamente tóxica del fósforo blanco. Las cerillas ordinarias se fabrican sumergiendo el extremo del fósforo en parafina, y a continuación, en una mezcla húmeda de sulfuro de fósforo, P4S3, dióxido de plomo u otro agente oxidante, y pegamento. Las cabezas de los fósforos de seguridad contienen trisulfuro de antimonio y clorato potásico o dicromato, y la tira de fricción (encendido) en la caja está recubierta con fósforo rojo, polvo de vidrio y pegamento.
El fósforo forma el hidruro PH3 que se llama fosfina. Es un gas muy venenoso.
Los fosfatos son valiosos fertilizantes y el uso anual de la roca fosfórica para este propósito, es de decenas de millones de toneladas. Se debe convertir a fosfato de calcio dihidrógeno (Ca(H2PO4)2) para ser asimilables por las plantas.
El fósforo común tiene una densidad nominal de 1,83 gm/cm3, pero en la forma blanca tiene una densidad de 5,7 y en la forma roja 5,1.
|