Superficie PvT para una Sustancia que se Expande al Congelarse
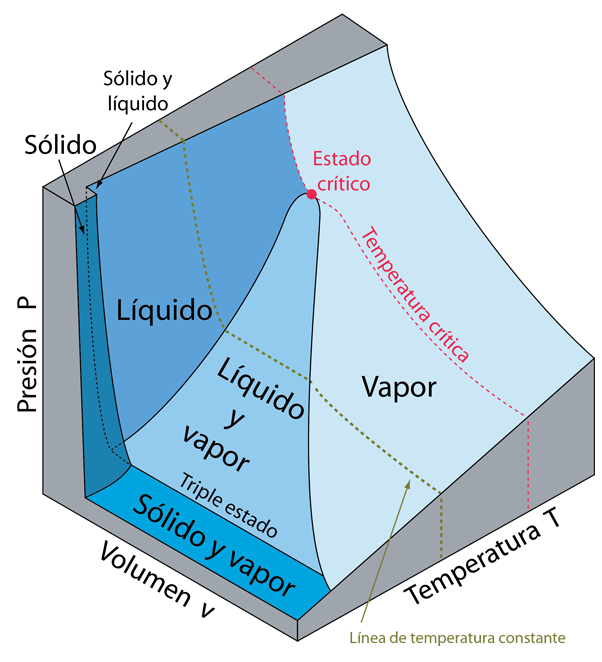
Los estados de equilibrio de una sustancia simple compresible, se pueden especificar en términos de su presión, volumen y temperatura. Si se especifica cualquiera de estas dos variables de estado, se determina la tercera. Esto implica que, los estados de una sustancia pueden ser representados como una superficie en un espacio tridimensional PvT. La superficie PvT anterior, representa una sustancia que se contrae al congelarse. La gran mayoría de sustancias se contraen al congelarse. La excepción notable es el agua, donde la expansión en la congelación tiiene un enorme impacto sobre la naturaleza de la Tierra. Con la superficie PvT, se puede ilustrar una cantidad considerable de información sobre las fases de la materia.
Las fases sólida, líquida y gas (vapor), se pueden representar por regiones en la superficie. Tenga en cuenta que hay regiones en la superficie que representan a una sola fase, y regiones que son combinaciones de dos fases. Un punto situado entre una región de una fase sola y una región de dos fases, representa un "estado de saturación". La línea entre las regiones de líquido y la de líquido-vapor, se llama línea de saturación de líquido, y cualquier punto en esa línea, representa un estado de líquido saturado. Un punto situado en el límite entre las regiones de vapor y líquido-vapor, se llama estado de saturación de vapor.
Note el punto de estado crítico (punto rojo), donde se unen las líneas de líquido-saturado con la de vapor saturado. Las variables de estado de este punto crítico único, se denotan por Pc, vc y Tc. Si una sustancia está por encima de la temperatura crítica Tc, no puede condensarse en un líquido, no importa cuán alta sea la presión. Esta fusión de los estados líquido y vapor por encima de la temperatura crítica es una característica de todas las sustancias conocidas. Mientras que por debajo de la presión crítica Pc, puede existir estado de vapor puro, a presión por encima de Pc, está limitado a ser vapor solamente. Los estados con presiones por encima de Pc se describen en los "estados supercríticos".
El notable "estado triple" de la materia, donde están en equilibrio los estados sólido, líquido y vapor, está caracterizado por una temperatura llamada de punto crítico. El estado triple se representa por una línea paralela al plano Pv, con una presión característica de la sustancia, pero con volumen variable. La temperatura crítica del agua se le asigna un valor de 273,16º K., y esta temperatura triple del agua se utiliza como referencia para establecer la escala de temperatura Kelvin.
| Tabla de Datos de Triple Estado |
Referencia
Wark y Richards
Cap. 3
| HyperPhysics*****Termodinámica | M Olmo R Nave |