Ley de Graham
Cuando los gases se disuelven en líquidos, la tasa relativa de difusión de un gas dado, es proporcional a su solubilidad en el líquido, e inversamente proporcional a la raíz cuadrada de su masa molecular. En el transporte de los gases de la respiración, es importante la velocidad de difusión relativa del oxígeno y el dióxido de carbono en el plasma del cuerpo humano. El dióxido de carbono tiene 22 veces la solubilidad del oxígeno, pero es más masivo (44 uma en comparación con 32 del oxígeno). De acuerdo con la ley de Graham, la tasa relativa de difusión está dada por
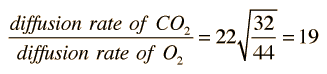
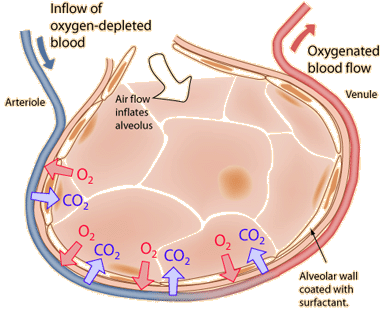 |
La ley de Graham se puede aplicar al proceso que se produce en los alvéolos de los pulmones. |
| Difusión | Ósmosis | Transporte de Membrana | Ley de Fick |
Conceptos de Teoría Cinética
Aplicaciones de Teoría Cinética
| HyperPhysics*****Termodinámica | M Olmo R Nave |