Comparación de las Propiedades de los Compuestos Iónicos y Covalentes
Debido a la naturaleza de los enlaces iónicos y covalentes, los materiales producidos por esos enlaces tienden a tener propiedades macroscópicas bastante diferentes. Los átomos de los materiales covalentes están firmemente unidos entre sí en moléculas estables, pero esas moléculas no están generalmente muy fuertemente atraídas a otras moléculas del material. Por otro lado, los átomos (iones) en los materiales iónicos muestran fuertes atracciones a los otros iones de sus alrededores. Esto conduce generalmente a bajos puntos de fusión en los sólidos covalentes, y altos puntos de fusión en los sólidos iónicos. Por ejemplo, la molécula de tetracloruro de carbono CCl4, es una molécula covalente no polar. Su punto de fusión es de -23°C. Por el contrario, el sólido iónico NaCl tiene un punto de fusión de 800°C.
Compuestos Iónicos
| Compuestos Covalentes
|
A partir de las posiciones de los componentes en la tabla periódica, se puede anticipar algunas cosas sobre los enlaces. Los elementos de los extremos opuestos de la tabla periódica forman generalmente enlaces iónicos. Tienen grandes diferencias en la electronegatividad y por lo general forman iones positivos y negativos. Los elementos con las electronegatividades más grandes están en la parte superior derecha de la tabla periódica, y los elementos con las electronegatividades más pequeñas se encuentran en la parte inferior izquierda. Si se combinan estos dos extremos, tal como en el RbF, la energía de disociación es grande. Como se puede ver en la siguiente ilustración, el hidrógeno es la excepción a esa regla, formando enlaces covalentes.
Los elementos que están muy juntos en electronegatividad tienden a formar enlaces covalentes y pueden existir como moléculas libres estables. El dióxido de carbono es un ejemplo común.
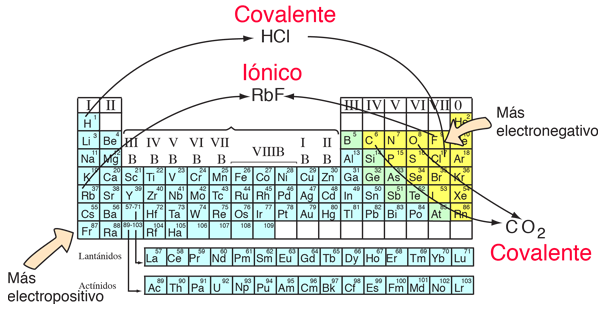
Conceptos de Enlace
Conceptos de Química
Referencia
Shipman, Wilson, Todd
Cap. 12
| HyperPhysics*****Física Cuántica*****Química | M Olmo R Nave |