Enlace Químico
Los compuestos químicos están formados por la unión de dos o más átomos. Un compuesto estable se produce cuando la energía total de la combinación es menor que la de los átomos separados. El estado de ligamiento implica una fuerza neta de atracción entre los átomos... un enlace químico. Los dos casos extremos de enlaces químicos son:
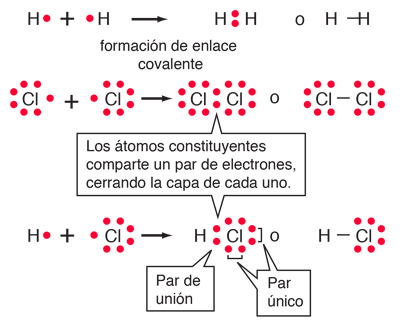
Enlace Covalente: el enlace en el que uno o más pares de electrones son compartidos por dos átomos.
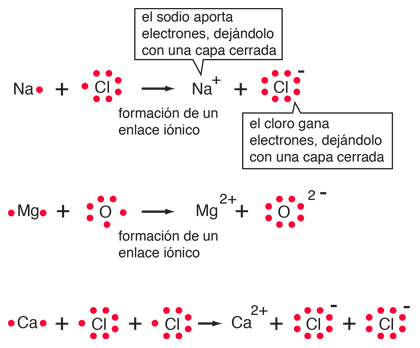
Enlace iónico: el enlace en el que uno o más electrones de un átomo es retirado y se une a otro átomo, resultando en iones positivos y negativos que se atraen entre sí.
En otros tipos de enlaces se incluyen los enlaces metálicos y los enlaces de hidrógeno. Las fuerzas de atracción entre las moléculas en un líquido se puede caracterizar como fuerzas de van der Waals.
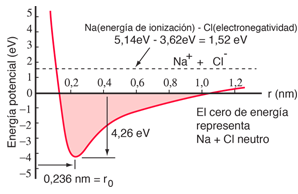 Cloruro Sódico Iónico | 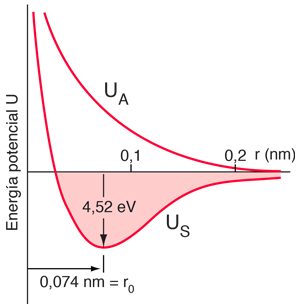 Molécula de Hidrógeno Covalente |
Conceptos de Enlace
Datos de Enlace
Conceptos de Química
| HyperPhysics*****Física Cuántica*****Química | M Olmo R Nave |