Momento Dipolar del Agua
|
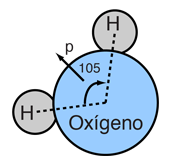
La asimetría de la molécula del agua lleva a un momento dipolar en el plano de simetría que marcan los átomos de hidrógenos mas positivos. La magnitud medida de este momento dipolar es 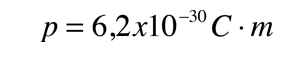 Tratando este sistema como una carga negativa de 10 electrones y una carga positiva de 10e, la separación efectiva de centros de carga negativos y positivos es 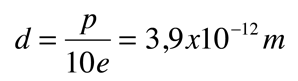 |
 |
Esta separación de carga de 0,0039 nm frente a unos 0,05 nm del primer radio de Bohr de un átomo de hidrógeno y alrededor de 0,15 nm para el radio efectivo del hidrógeno en forma líquida, es pequeña comparada con el radio atómico.
La naturaleza polar de las moléculas del agua, les permite vincularse entre ellas en grupos y se asocia con la alta tensión de superficie del agua.
Conceptos sobre Voltaje
Conceptos sobre Dipolo Eléctrico
Referencia
Halliday, Resnick, Walker
Sec 24.9
| HyperPhysics*****Electricidad y Magnetismo | M Olmo R Nave |
