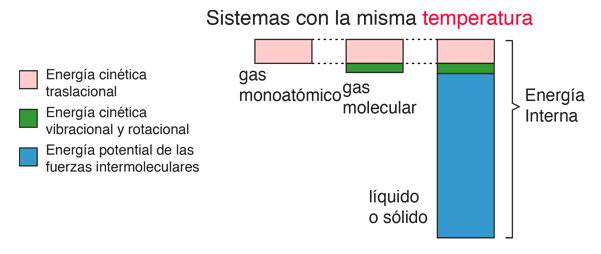
Energía Interna
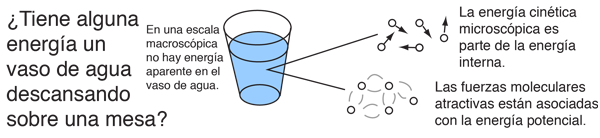
La energía interna se define como la energía asociada con el movimiento aleatorio y desordenado de las moléculas. Está en una escala separada de la energía macroscópica ordenada, que se asocia con los objetos en movimiento. Se refiere a la energía microscópica invisible de la escala atómica y molecular. Por ejemplo, un vaso de agua a temperatura ambiente sobre una mesa, no tiene energía aparente, ya sea potencial o cinética. Pero en escala microscópica, es un hervidero de moléculas de alta velocidad que viajan a cientos de metros por segundo. Si el agua se tirase por la habitación, esta energía microscópica no sería cambiada necesariamente por la superimposición de un movimiento ordenada a gran escala, sobre el agua como un todo.
Las cantidades relacionadas con la energía, que son particularmente útiles en la termodinámica química son la entalpía, la energia libre de Helmholtz, y la energía libre de Gibbs.
| Temperatura y Energía Cinética | Equipartición de Energía | Energía Térmica |
| ¿Se Puede Predecir la Trayectoria de una Molécula como la de una Pelota de Beisbol? |
Conceptos sobre Energía Interna
| HyperPhysics*****Termodinámica | M Olmo R Nave |