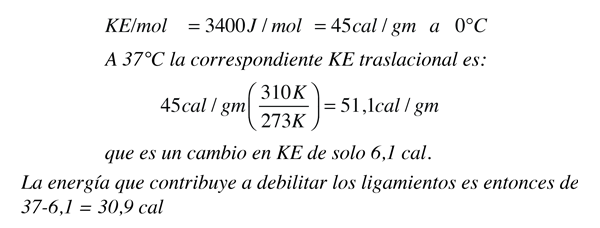Detalles de Energía Relacionados con el Calentamiento del Agua
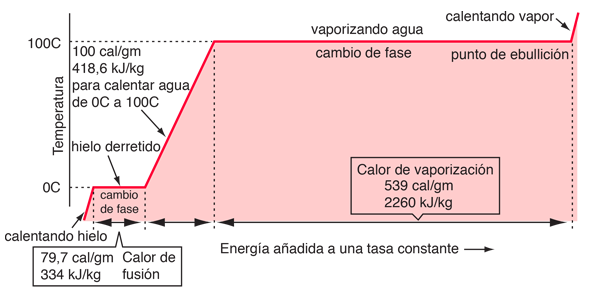
En el proceso del calentamiento del agua desde 0º a 100º C., se añadió 100 calorías de energía. Parte de esa energía aumentó la energía cinética de las moléculas y alguna otra se sumó a la energía potencial. Para evaluar la cantidad añadida a la energía cinética, se deben evaluar las velocidades moleculares en las dos temperaturas con ayuda de la distribución de velocidad de Boltzmann.

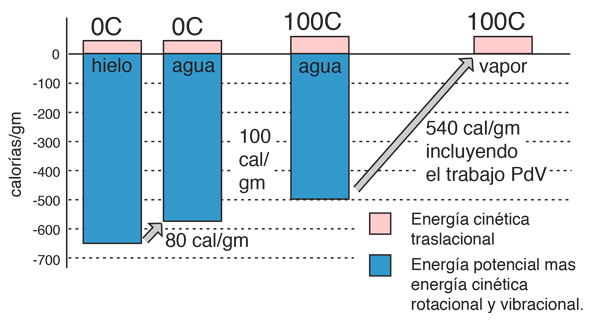
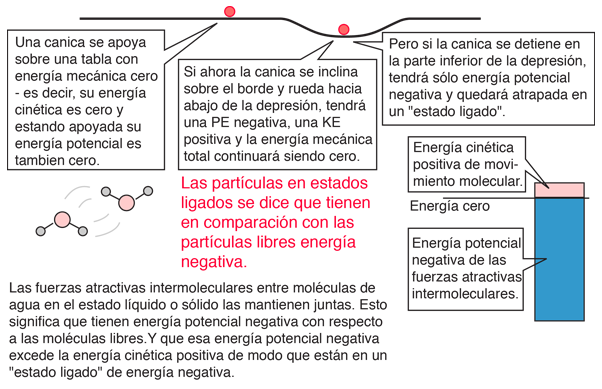
La ganancia neta en energía cinética, cuando se calienta el agua de 0º a 100º C., es entonces 16,7 calorías/gramo. El resto de la energía se va a debilitar la fuerza de atracción entre las moléculas del agua. Esta debilitación de las fuerzas intermoleculares se manifiesta, en la reducción de la tensión de superficie del agua caliente.
En el proceso de vaporización del agua, se debe añadir una gran cantidad de energía para superar las fuerzas de cohesión restantes entre las moléculas. Una parte adicional de esa energía, se convierte en trabajo PdV, para expandir el gas desde su pequeñísimo volumen líquido, al volumen del vapor resultante.

Si el calor de vaporización del agua a 100°C es 539 calorías, entonces, restando la componente de trabajo de 41 calorías, sugiere que el consumo real de la energía de unión de las moléculas del agua a 100°C, es 539-41=498 calorías.
¿Por Que, el Calor de Vaporización es Mayor en el Cuerpo Humano?
Una característica interesante del proceso de enfriamiento del cuerpo humano por evaporación, es que el calor extraído por la evaporación de un gramo de sudor de la piel humana a la temperatura corporal (37° C.), se cita en los libros de fisiología como 580 calorías/g., en lugar del nominal 540 calorías/g. en el punto normal de ebullición. La pregunta es, ¿por qué es mayor a la temperatura corporal.
La parte principal de la respuesta es, que la energía de enlace de las moléculas de agua es mayor a esa temperatura más baja, y por lo tanto, necesita más energía para separarlas, y llevarlas al estado gaseoso. El cambio en el calor de vaporización, se puede calcular más o menos, utilizando lo que sabemos del agua (calor específico del agua, 1 caloría/gm °C.). Se necesitan 37 calorías para calentar un gramo de agua de 0°C a 37°C., pero el cambio en la energía cinética es mucho menor que:
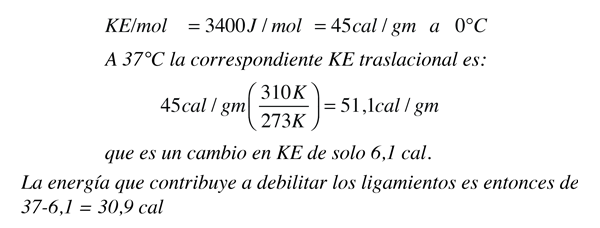
Se ha demostrado anteriormente que cuando se calienta el agua de cero a 100°C., la energía cinética de las moléculas de agua sólo aumenta un 61,7 - 45 = 16,7 calorías/g., pero sabemos que se necesitan 100 calorías para hacer que el calentamiento. Por lo tanto, la contribución al debilitamiento de los lazos del agua es 83,3 cal/g. Utilizando el resultado del agua a 37°C., es evidente que debe suministrarse 52,4 calorías de energía adicional, para evaporar el agua a 37°C.
Hay un elemento adicional en el modelado del calor de vaporización a la temperatura del cuerpo -el trabajo PdV necesario para llevar el agua al estado gaseoso es ligeramente inferior a 37°C.-. Por analogía con el cálculo del trabajo de arriba, se encontró que ese trabajo es 34,2 calorías/g, 6,8 calorías/g menos que a 100°C.
Entonces este modelo sugiere un calor de vaporización a 37°C.:
Calor de vaporización a la temperatura corporal = 539 cal/gm + 52,4 cal/gm - 6,8 cal/gm = 585 cal/gm.
Por lo que este modelo simple, está bastante bien de acuerdo con el citado de 580 cal.
|
Índice
Conceptos sobre Cambio de Fase |