El Cloruro de Sodio, NaCl
El caso clásico de enlace iónico, la molécula de cloruro de sodio, se forma por la ionización de los átomos de sodio y cloro, y la atracción de los iones resultantes.
El átomo de sodio tiene 3 electrones fuera de una capa completa, y toma sólo 5,14 electrón voltios de energía, para liberar ese electrón. Al cloro le falta un electrón para completar una capa, y libera 3,62 eV cuando adquiere ese electrón (su afinidad electrónica es 3,62 eV). Esto significa que cuando están muy separados, sólo se necesita 1,52 eV de energía para donar uno de los electrones del sodio al cloro. Cuando los iones resultantes se aproximan entre sí, su energía potencial eléctrica se hace más y más negativa, alcanzando -1,52 eV a una separación de aproximadamente 0,94 nm. Esto significa que, si se encontraran átomos neutros de sodio y de cloro más cerca que 0,94 nm de separación, estarían energéticamente favorable para transferir un electrón de Na al Cl, y formar un enlace iónico.
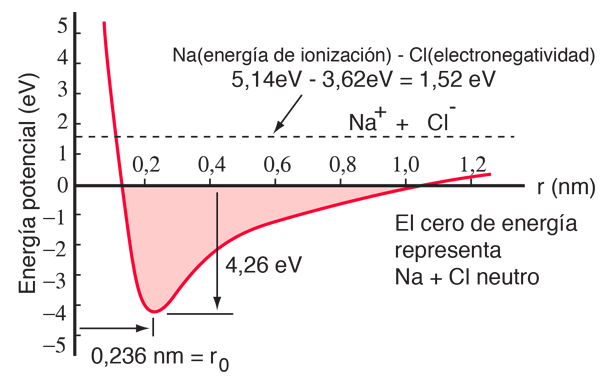
La curva de energía potencial muestra que hay un mínimo a una separación de 0,236 nm y luego un fuerte aumento en el potencial que representa una fuerza de repulsión. Esta fuerza de repulsión es más que solamente una repulsión electrostática entre las nubes de electrones de los dos átomos, tiene un carácter mecánico cuántico basado en el principio de exclusión de Pauli, y a menudo se llama simplemente "repulsión por principio de exclusión". Cuando los iones están muy separados, las funciones de onda de sus electrones principales no se superponen de manera significativa, y pueden tener idénticos números cuánticos. A medida que se acercan, la creciente superposición de las funciones de onda, hace que algunos se vean obligados a estados de energías más altos. Dos electrones no pueden ocupar el mismo estado, de manera que cuando se forma un nuevo conjunto de estados de energía, un sistema de dos núcleos, los estados de menor energía se llenan y algunos de los electrones son empujados a estados superiores. Esto requiere energía, y se experimenta como una repulsión, preveyendo que los iones se puedan acercar mas uno al otro.
El diagrama de potencial de arriba es para el NaCl gaseoso, y el entorno es diferente en el estado normal sólido, donde el cloruro de sodio (sal de mesa común) forma cristales cúbicos. La separación de iones es de 0,28 nm, algo mayor que la del estado gaseoso.
Una parte importante del estudio de la estructura molecular es la descripción de los enlaces químicos que se forman entre los átomos. Los estudios clásicos lo forman los extremos de la unión iónica en el cloruro de sodio, y el enlace covalente en la molécula de hidrógeno.
| Enlaces Químicos | Repulsión de Pauli en los Enlaces Iónicos |
| Ejemplo de Energía de Enlace |
Referencia
Tipler
Elem. Modern Physics, Cap. 5
| HyperPhysics*****Física Cuántica*****Química | M Olmo R Nave |