Baterías Carbono-Zinc
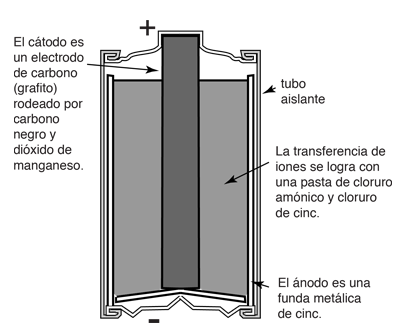
| La venerable pila de carbono-zinc o pila de Lechlanche, se invento en 1866 y fué la mas común de las baterías pequeñas durante la mayor parte del siglo 20, hasta que fué reemplazada por las pilas alcalinas. The oxidationLa oxidación en el electrodo de zinc (el ánodo) es sencilla y similar a la de otras células, como la pila Daniell. Las otras reacciones implican el MnO2que se encuentra cerca del centro de la varilla de carbono y el NH4Cl y el ZnCl2 que constituyen el grueso de la pasta entre el cátodo y el ánodo. |
Las reacciones químicas en esta pila se pueden aproximar por
Zn(s) -> Zn2+(aq) + 2e- |
|
2NH4+(aq) + 2MnO2(s) + 2e- -> Mn2O3(s) + H2O(l) + 2NH3(aq) |
|
Parte de la complejidad de esta reacción viene del hecho de que la reducción del ión amonio, produce dos productos gaseosos
2NH4+(aq) + 2e- -> 2NH3(g) + H2(g)
que debe ser absorbida para evitar la acumulación de presión del gas. Eso se consigue con dos reacciones adicionales en la pasta de electrolito. El cloruro de zinc reacciona con el amonio para formar el cloruro amonio de zinc sólido y el dióxido de manganeso reacciona con el hidrógeno para formar trióxido de manganeso sólido mas agua (Hewitt).
ZnCl2(aq) + 2NH3(g) -> Zn(NH3)2Cl2(s)
2MnO2(s) + H2(g) -> Mn2O3(s) + H2O(l)
El voltaje de esta pila es de alrededor de 1,5 voltios, pero disminuye a medida que se va gastando. Tambien tiene una vida útil corta y se deteriora rapidamente con el clima frío. La oxidación de la pared de zinc con el tiempo hace que el contenido se filtre, por lo que este tipo de baterías no se deben dejar en los equipos eléctricos durante largos períodos. Aunque estas baterías tienen una larga historia de utilidad, su aplicación se ha visto reducida, ya que algunos de sus problemas se resuelven con las pilas alcalinas.
| Baterías |
Circuitos DC
Referencias
Floyd
Electric Circuit Fundamentals, App. B
Ebbing
Cap. 19
Hewitt
Phys. Sci. Ch 20
| HyperPhysics*****Electricidad y Magnetismo | M Olmo R Nave |