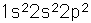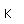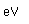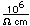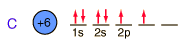Carbono
El carbono forma más compuestos químicos que cualquier otro elemento excepto el hidrógeno. Muchos de los productos químicos en los organismos vivos son los hidrocarburos. El campo de la química orgánica es fundamentalmente la química de los compuestos de carbono. El carbono se une al oxígeno para formar el ion carbonato CO32- y contribuye a una importante clase de minerales, los carbonatos.
El carbono tiene una densidad de 2,26 en la forma de grafito, y 3,51 en la forma de diamante. Las formas cristalinas del diamante imperfectamente formadas se llaman bort o diamante negro. Son ligeramente menos densa que el diamante, y son algo más dura y resistente. Se utilizan para brocas de diamante y abrasivos.
Mientras que el diamante es la sustancia más dura, varios compuestos de carbono llamados carburos rivalizan en dureza. El carburo de boro, B4C, es el mas duro despues del diamante, pero varios de los carburos metálicos son extremadamente duros y encuentran aplicación como aristas de corte en herramientas de alta velocidad.
Los diamantes y otras piedras preciosas se miden a veces en quilates, un término derivado de la palabra griega que significa pepita de algarroba. Las pepitas de algarroba se utilizaron una vez como medidas de peso. Un quilate es igual a 0,007 onzas. El diamante Cullinan, encontrado en Sudáfrica en 1905, pesaba 3.106 quilates.
 |
Esta muestra de carbono en forma de grafito se exhibe en el Museo Smithsonian de Historia Natural. La muestra tiene aproximadamente 13x13 cm y es de Ticonderoga, Nueva York. Está formada con calcita. |
Diamante en exhibición en el Museo Smithsonian de Historia Natural. |
 |
A continuación se muestra la expectativa de la orden de llenado general de los orbitales electrónicos, pero una parte importante en la unión del carbono es la formación de orbitales híbridos sp3.
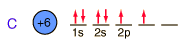
|