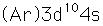Cobre
El cobre es un metal rojo, áspero, con un punto de fusión moderadamente alto. Es un excelente conductor del calor y de la electricidad y encuentra un amplio uso como conductor eléctrico.
El cobre puro es blando y puede ser convertido en alambre o moldeado en las formas deseadas. Estos procesos de conformación hacen que el metal se vuelva duro, porque los grandes granos de cristal se descomponen en pequeños granos, fortaleciendo el metal. Si el cobre es posteriormente calentado (recocido), se puede volver de nuevo blando.
El latón está formado por una aleación de cobre y zinc. Si se añade estaño, se obtiene el bronce. Las aleaciones de cobre y aluminio son llamadas bronce de aluminio.
El sulfato de cobre (CuSO4.5H20) es un compuesto común de cobre. El sulfato de cobre se utiliza en el chapado de cobre, en la impresión de telas, y en las células eléctricas. Los nombres comunes son vitriolo azul y piedra azul.
El cobre metálico aparece en la naturaleza en una variedad de formas minerales. Aparece con magnesio en el mineral de carbonato callaghanita. El mineral de carbonato malachita tiene un rico color verde oscuro que lo hace un material decorativo ampliamente utilizado. Su carbonato compañero la azurita, tiene un intenso color azul.
La cuprita es la forma mineral del óxido Cu2O. Otro óxido de cobre mas raro es la paramelaconita, Cu4O3. El cobre forma un óxido de hierro llamado delafossita. Un óxido de cobre con zinc, vanadio y plomo es la mottramita.
El cobre forma los sulfuros covellita, CuS, calcocita, Cu2S, y digenita, Cu9S5. Con hierro forma la calcopirita, CuFeS2, con antimonio forma la calcostibita, CuSbS2 y con arsénico forma la calcofilita. El cobre también forma un sulfuro con bismuto llamado emplectita, CuBiS2. Forma un sulfuro con antimonio y hierro llamado tetrahedrita.
Los sulfuros con hierro incluyen la bornita, Cu5FeS4, y la cubanita, CuFe2S3. Un sulfuro con arsénico se llama enargita. La bournonita es un sulfuro con cobre, plomo y antimonio. La tennantita es un sulfuro que contiene cobre, arsénico, hierro y antimonio. El plomo, cobre y hierro se juntan en el sulfuro betekhtinita. La germanite es un sulfuro que contiene cobre, germanio y hierro. La stannita es un sulfuro con estaño y cobre. El cobre con plata y antimonio forma el sulfuro polybasita.
Se presenta en forma de sulfato en la antlerita, la brochantita, la connellita, la cyanotrichita y la devillina.
El cobre aparece con plomo en la caledonita. El cobre, el cobalto y el níquel se unen en el sulfuro carrollita. Un color verde llamativo es exhibido por el mineral bayldonita que combina cobre, cinc y plomo con un grupo arseniato. Otro mineral de cobre verde es el arseniato de cobre olivenita, Cu2AsO4(OH). Otro arseniato de cobre es la clinoclasa. La duftite es un mineral arseniato de plomo y cobre. El silicato de cobre en el mineral dioptasa también exhibe un color verde. La dioptasa está a veces acompañada por un raro silicato de cobre, la plancheita. El cobre aparece como cloruro en la atacamita, la boleita y la cumengita. Un cloruro de cobre y plomo es la diaboleita. El cobre aparece como un fosfato en la cornetita.
El cobre constituye el mineral de fosfato libethenite. El cobre aparece con uranio en el mineral de fosfato metatorbernita.
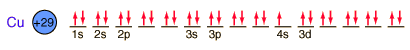
El cobre es una de las pocas excepciones a la orden de llenado general de los orbitales electrónicos, llenando los diez estados 3d antes de llenar el segundo estado 4s.
|
Índice
Tabla Periódica
Conceptos de Química
Referencia
Pauling
Cap. 28 |