Celda de Combustible de Hidrógeno
En una batería de combustible, se pueden combinar el hidrógeno y el oxígeno para producir energía eléctrica. Una celda de combustible, usa una reacción química para suministrar un voltaje externo como lo hace una batería, pero difiere de esta, en que el combustible se suministra continuamente en forma de gases hidrógeno y oxígeno. Puede producir energía eléctrica para convertirla en calor que impulse un generador, con una eficiencia mayor que la quema de hidrógeno, porque no está sujeta al cuello de botella térmico determinado por la segunda ley de la termodinámica. Su único producto es el agua, de modo que está libre de polución. Todas estas características han dado lugar a periódicas grandes muestras de entusiamo sobre su potencial, pero todavía estamos en el proceso de desarrollo de ese potencial, como una fuente de energía eficiente y libre de polución (ver Kartha y Grimes).
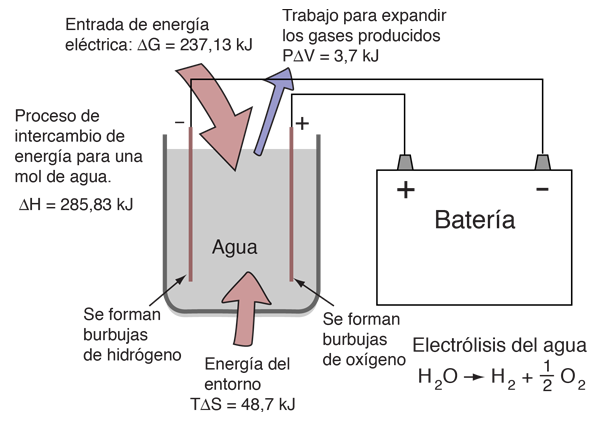
Téngase en cuenta que cuando aquí se usa el descriptor "fuente de energía eficiente", simplemente se refiere a la eficiencia relativa con la que la energía se aplica a una tarea, no que sea la fuente principal de esa energía. La celda de combustible no genera energía, sino simplemente transforma la energía contenida en el combustible de hidrógeno y oxígeno en una salida de energía eléctrica útil. La practicidad general de las pilas de combustible depende de la eficiencia del proceso de producción de los combustibles de hidrógeno y oxígeno que alimentan las celdas. La obtención de los combustibles de hidrógeno y el oxígeno de otras fuentes de energía más primarias han demostrado estar limitadas en la aplicación de celdas de combustible. Si la energía solar o eólica se pudiera usar eficientemente para electrolizar el agua, se mejoraría la practicidad de las celdas de combustible.
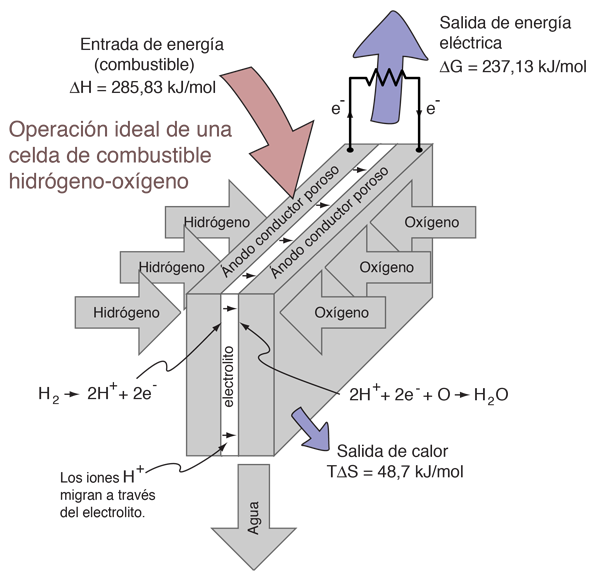
La combinación de una mol de gas hidrógeno y media mol de gas oxígeno en sus formas diatómicas normales, produce una mol de agua. Un detallado análisis del proceso, hace uso de los potenciales termodinámicos. Este proceso se realiza a 298ºK y a una atmósfera de presión, y los valores relevantes se toman de una tabla de propiedades termodinámicas.
| Cantidad | H2 | 0,5 O2 | H2O | Cambio |
| Entalpía | 0 | 0 | -285,83 kJ | ΔH = -285,83 kJ |
| Entropía | 130,68 J/K | 0,5 x 205,14 J/K | 69,91 J/K | TΔS = -48,7 kJ |
La energía se suministra para la combinación de los átomos, y para la disminución del volumen de los gases. Ambos están incluidos en el cambio de la entalpía reflejada en la tabla de arriba. A la temperatura de 298ºK y una atmósfera de presión, el trabajo del sistema es
W = PΔV = (101,3 x 103 Pa)(1,5 moles)(-22,4 x 10-3 m3/mol)(298ºK/273ºK) = -3715 J
Como la entalpía H= U+PV, el cambio en la energía interna U es entonces
ΔU = ΔH - PΔV = -285,83 kJ - 3,72 kJ = -282,1 kJ
En el proceso de combinación, la entropía de los gases disminuye en 48,7 kJ, porque el número de moléculas de agua es menor que la combinación del número de moléculas de hidrógeno y oxígeno. Puesto que la entropía total no puede disminuir en la reacción, el exceso de entropía en la cantidad TΔS, se debe expulsar al medio ambiente en forma de calor a la temperatura T. La cantidad de energía por mol de hidrógeno que se puede suministrar como energía eléctrica, es el cambio en la energía libre de Gibbs:
ΔG = ΔH - TΔS = -285,83 kJ + 48,7 kJ = -237,1 kJ
En este caso ideal, la energía del combustible se convierte en energía eléctrica con una eficiencia del 237,1/285,8x100% = 83%! ¡Esto es mucho mayor que la eficiencia ideal de una planta de generación, donde queman hidrógeno y se utiliza el calor para mover un generador!. Aunque las células de combustible real no se acercan a la eficiencia ideal, siguen siendo mucho más eficientes que cualquier otra planta de energía eléctrica que quema combustible.
Comparación de los Procesos de Electrólisis y Células de Combustible
Al comparar el proceso de célula de combustible con su reacción inversa la electrólisis del agua, es útil tratar el cambio de entalpía como el cambio total de energía. La energía libre de Gibbs, es la que realmente tenemos si queremos alimentar un proceso de reacción, o la cantidad de energía que obtenemos, si la reacción está trabajando para nosotros. Así pues en el par electrólisis/celda de combustible, donde el cambio en la entalpía es de 285,8 kJ, tenemos que poner 237 kJ de energía para impulsar la electrólisis, y el calor del medio ambiente contribuirá con TΔS=48,7 kJ para ayudarnos. Por otro lado en la celda de combustible, podemos sacar los 237 kJ como energía eléctrica, pero tenemos que tirar al medio ambiente TΔS = 48.7 kJ.
|
Índice
Conceptos sobre Energía Interna
Conceptos sobre Electroquímica
Referencia
Schroeder
Cap. 5
Kartha & Grimes |