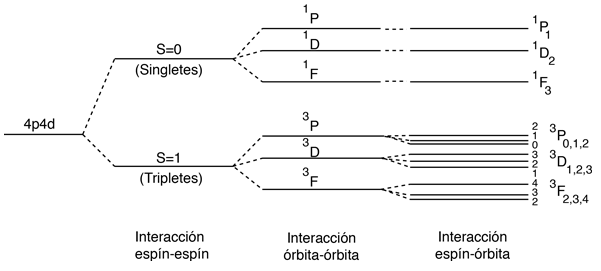
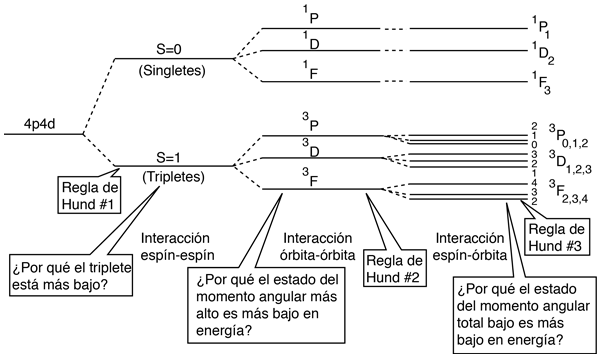
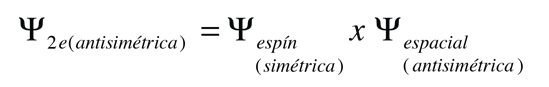La Interacción Espín-Espín
El efecto de la interacción espín-espín se señala en la regla de Hund # 1. Si se tienen dos electrones, el estado en el que sus espines están paralelos (S=1, el estado triplete), será de menor energía que el estado en el que sus espines son antiparalelos (S=0, estado singlete).
Este resultado se correlaciona con el hecho de que los dos electrones son fermiones idénticos, y la función de onda que describe el par debe ser antisimétrica con respecto al intercambio de los electrones (un requisito del principio de exclusión de Pauli). La función de onda puede ser considerada como el producto de las funciones de onda espacial y de espín:
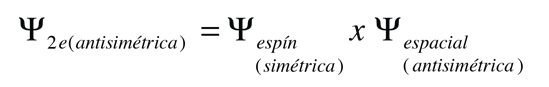
El hecho de que los espines sean paralelos, hace que sea simétrica la parte del espín de la función de onda, y fuerza a la parte espacial a ser antisimétrica. Una función de onda espacial anti-simétrica de los dos electrones, implica una mayor distancia promedio entre ellos, que una función simétrica del mismo tipo. La probabilidad es el cuadrado de la función de onda, y a partir de un simple punto de vista funcional, el cuadrado de una función antisimétrica debe ir a cero en el origen. Así, en general, la probabilidad de pequeñas separaciones entre los dos electrones, es menor que para una función de onda espacial simétrica. Si los electrones están más separados en promedio, entonces habrá menos protección del núcleo por el otro electrón, y un electrón dado por lo tanto, estará más expuesto al núcleo. Esto implica que estará más fuertemente ligado y con menor energía.
|
Índice
Conceptos de Estructura Atómica |