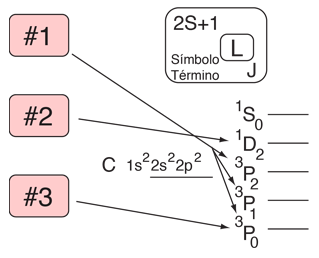
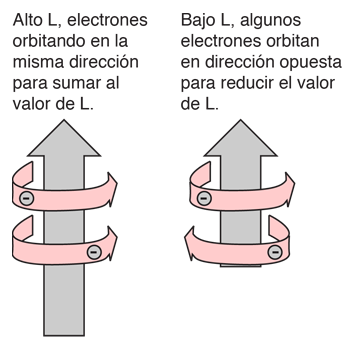
Regla de Hund #1
El término con la máxima multiplicidad se encuentra en la mas baja energía.
Ejemplo: En la configuración p2 esperamos el orden
3P < (1D,1S).
La explicación de la norma radica en los efectos de la interacción espín-espín. Aunque a menudo se llama interacción espín-espín, el origen de la diferencia de energía se encuentra en la repulsión de Coulomb de los electrones. Es que justamente un estado de espín simétrico, fuerza un estado espacial antisimétrico, donde los electrones están en promedio más separados, y proporcionan menos apantallamiento a los demás, produciendo una energía más baja. Los bocetos de abajo intentan visualizar por qué eso es así.
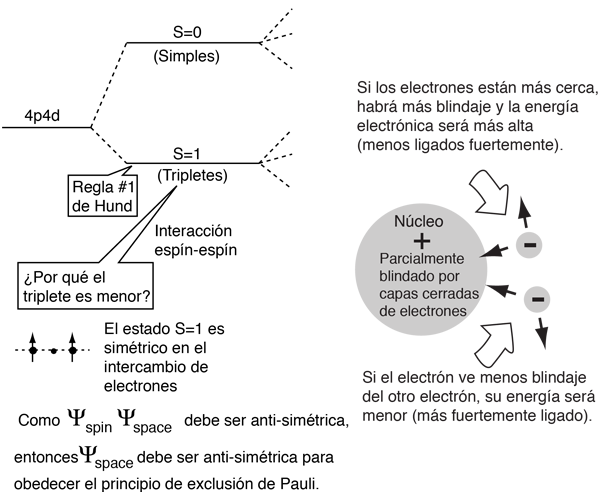
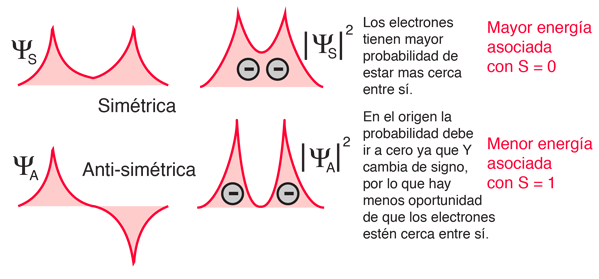
Estos esquemas son solamente conceptuales. No se ha tratado de hacer ningún ajuste realista.
Téngase en cuenta que las energías que se están discutiendo aquí son energías potenciales eléctricas, de modo que un electrón negativo en las proximidades de un núcleo positivo tendrá una energía negativa que conduce a un estado ligado. Cualquier fuerza entre los electrones tienden a contrarrestar esta situación, aportando una energía potencial positiva, que hace que los electrones estén menos fuertemente ligados, o más alto en energía potencial.
|