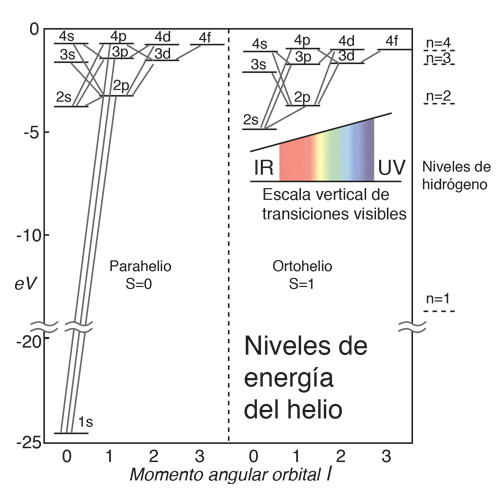
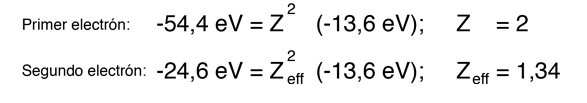Niveles de Energía del Helio
El estado fundamental del helio tiene dos electrones idénticos 1s. La energía requerida para extraer uno de ellos, es la energía de ionización más alta de cualquier átomo en la tabla periódica: 24,6 electronvoltios. La energía necesaria para extraer el segundo electrón es 54,4 eV, como sería de esperar, según el modelado de los niveles de energía del hidrógeno. El ión He+, es justo como un átomo de hidrógeno, con dos unidades de carga en el núcleo. Dado que los niveles de energía del hidrógeno dependen del cuadrado de la carga nuclear, la energía del electrón restante del helio, debe ser justo 4x(-13,6 eV) = -54,4 eV., como se observó.
El hecho de que el segundo electrón esté unido con menos fuerza, se puede interpretar como un efecto del blindaje; el otro electrón blinda parcialmente el segundo electrón, de la carga completa del núcleo. Su energía puede ser utilizada, para modelar el blindaje eficaz de la siguiente manera.
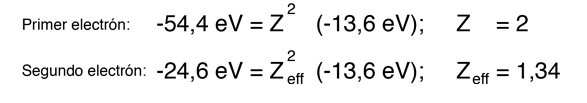
Otra forma de ver la energía es, decir que la repulsión de los electrones contribuye a la energía potencial positiva, que compensa parcialmente la energía potencial negativa, presentada por la fuerza de atracción eléctrica de la carga nuclear. La descripción de cualquier electrón en un átomo multi-electrónico, debe encontrar una manera de caracterizar el efecto de los otros electrones sobre la energía.
|
Índice
Referencia
Rohlf
Cap. 9 |