Niveles de Energía del Nitrógeno
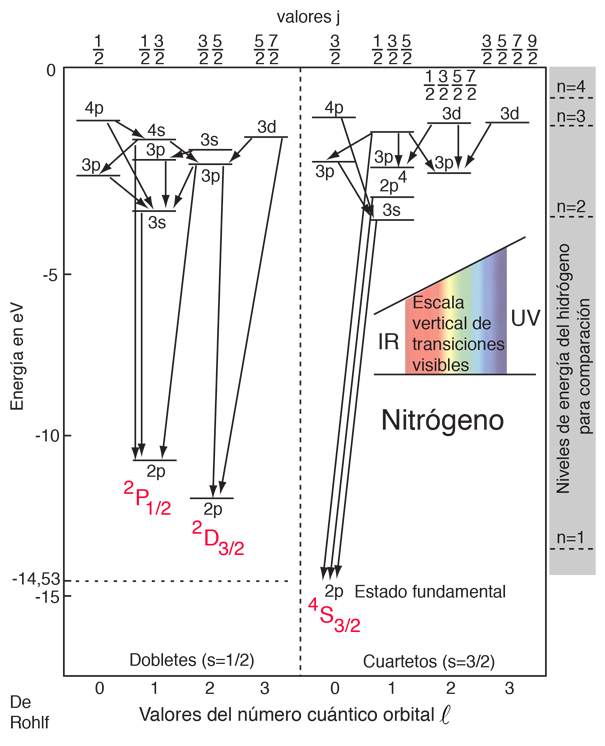
Con una configuración electrónica de 1s22s22p3, el elemento nitrógeno tiene tres electrones fuera de las capas completas. Los tres espines pueden dar una resultante de espín 3/2 (estado cuarteto) o 1/2 (estado doblete). En el diagrama anterior, se presume que dos de los electrones permanecen en sus estados más bajos, y las etiquetas en minúsculas sobre los niveles, especifican el estado del electrón elevado. Las etiquetas en mayúsculas representan estados colectivos de los tres electrones p.
El estado fundamental tiene los tres espines alineados en el estado 4S3/2, el estado de mayor multiplicidad, de conformidad con la regla de Hund #1. Hay otros dos estados 2p asociados con espín S = 1/2 (dobletes) para los que los símbolos colectivos son 2P1/2 y 2D3/2. El estado 2D3/2 es menor, de acuerdo con la regla de Hund #2. Aquí no se muestra este desdoblamiento con diferentes valores de j.
Las líneas que conectan los niveles indican transiciones radiativas, que están sujetas a las reglas de selección dependiendo de los momentos angulares.
| Diagramas de Nivel de Energía del Electrón |
Referencia
Rohlf
Cap. 9
| HyperPhysics*****Física Cuántica | M Olmo R Nave |