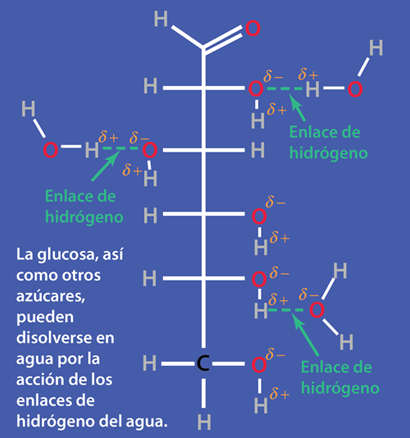
El Agua. El Disolvente para la Vida
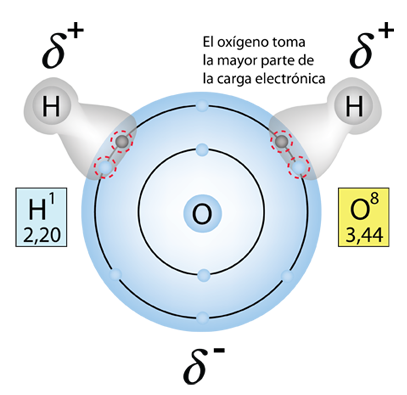
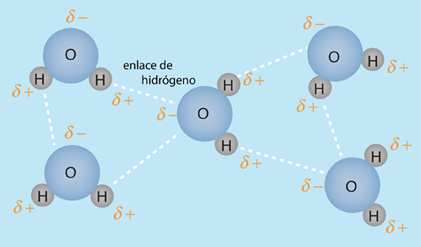
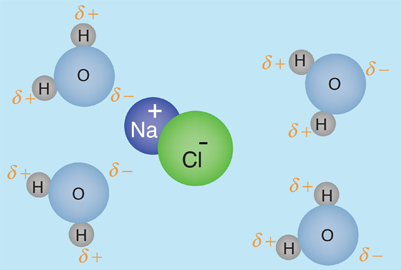
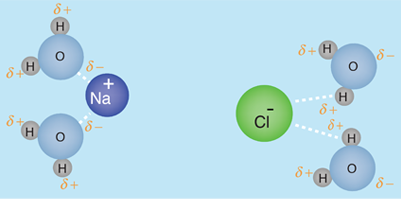
De acuerdo con Hill y Kolb el cuerpo humano tiene un 66% de agua en peso. Referida por el premio Nobel A. Szent-Gyorgy como "la matriz de la vida", el agua es el disolvente universal de la vida. Ese agua sirve como disolvente del cloruro sódico (sal) y otras sustancias, por lo que los fluidos de nuestro cuerpo son similares al agua del mar. Esto lleva a Hill y Kolb a referirse jocosamente a nosotros como "bolsas caminantes de agua de mar". El agua sirve para sostener las células rojas de la sangre para transportar oxígeno a las células. Es el disolvente de los electrolitos y nutrientes necesarios para las células, así como el disolvente para llevar el material de desecho fuera de las células.
Con el agua como disolvente, la presión osmótica actúa para transportar el agua que se necesita en la células. Con las células bañadas en el fluido intersticial, la difusión contribuye a llevar las moléculas necesarias en las células. Cuando mecanismos más complejos controlan el transporte de moléculas a través de las membranas hacia dentro y fuera de las células, la presencia del agua es esencial como medio circundante y disolvente.
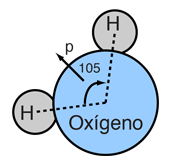 |
Conceptos del Agua
Conceptos de Química
Referencia
Hill & Kolb
Cap. 13 "Water"
| HyperPhysics*****Química | M Olmo R Nave |