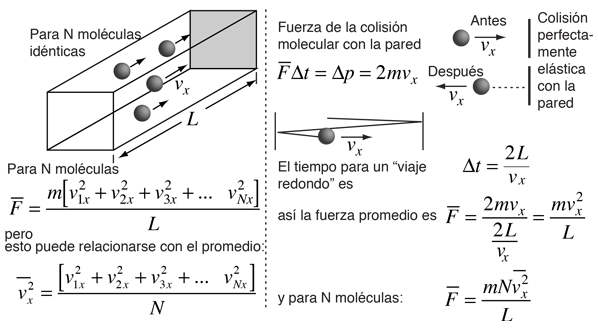
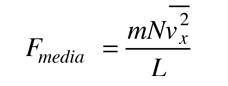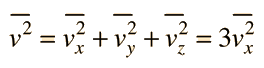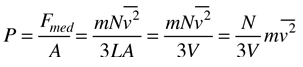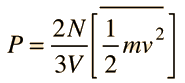Teoría Cinética
La teoría cinética de gases, es el estudio del comportamiento microscópica de las moléculas y sus interacciones, que nos llevan a fórmulas macroscópica como la ley de gas ideal.
El estudio de las moléculas de un gas, es un buen ejemplo de una situación física en que los métodos estadísticos, proporcionan resultados precisos y confiables para las manifestaciones macroscópicas de los fenómenos microscópicos. Por ejemplo, los cálculos de la presión, volumen y temperatura de la ley del gas ideal son muy precisos. El promedio de energía asociada con el movimiento molecular tiene su fundamento en la distribución de Boltzmann, una función de distribución estadística. Sin embargo, la temperatura y la energía de un gas se pueden medir con precisión.
| Comentario sobre Métodos Estadísticos | Comentario sobre el papel de la Distribución de Boltzmann |
| Distribución de Velocidad Molecular | Separación entre Moléculas en un Gas Ideal |
Conceptos sobre Teoría Cinética
| HyperPhysics*****Termodinámica | M Olmo R Nave |