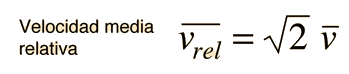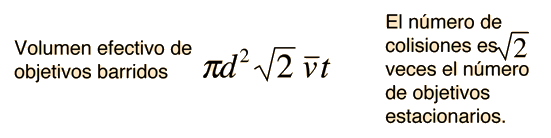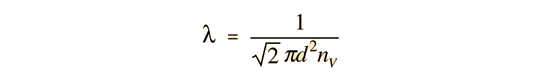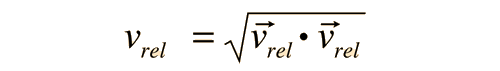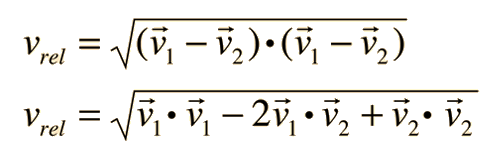Recorrido Libre Medio
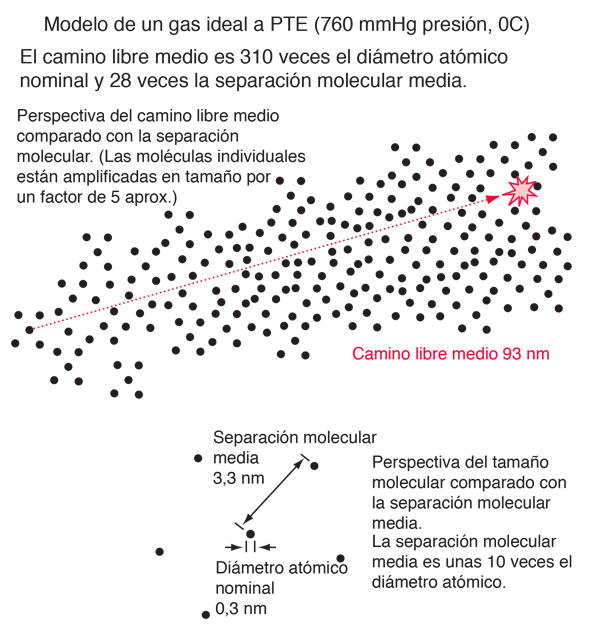
El camino o recorrido libre medio o distancia promedio entre colisiones en las moléculas de gases, se puede obtener desde la teoría cinética. El enfoque de Serway es una buena aproximación. Si las moléculas tienen el diámetro d, entonces la sección transversal efectiva para las colisiones, se puede modelar por
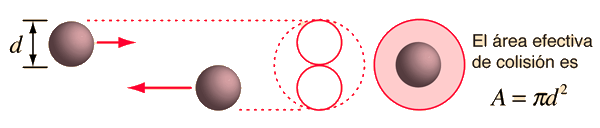
donde hemos usado un círculo de diámetro 2d, para representar el área de la colisión efectiva de la molécula, mientra tratamos las moléculas "objetivas" como masas puntuales. En el tiempo t, el círculo barrerá el volumen mostrado, y el número de colisiones se puede estimar a partir del número de moléculas de gas, contenidas en ese volumen.

El camino libre medio, sería entonces igual a la longitud del camino dividido por el número de colisiones.

El problema con esta expresión es que se usa la velocidad molecular media, pero las moléculas "dianas", también se están moviendo. La frecuencia de las colisiones depende de la velocidad relativa media de las moléculas que se mueven aleatoriamente.
| Refinamiento del Camino Libre Medio | Calcular | Frecuencia de las Colisiones |
Conceptos sobre la Ley de Gas
Conceptos sobre Teoría Cinética
| HyperPhysics*****Termodinámica | M Olmo R Nave |