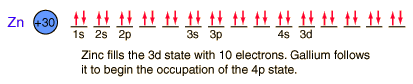
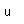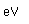Zinc
El zinc es un metal moderadamente duro de color blanco azulado. Es frágil a temperatura ambiente y a temperaturas superiores a 150°C, siendo utilizable sólo en el intervalo entre 100°C y 150°C. Es un metal activo y desplazará hidrógeno incluso a partir de ácidos diluidos.
El uso principal del zinc está en la galvanización de chapas de hierro o alambres. En aire húmedo, el zinc se oxida y se recubre con una película dura de carbonato de zinc, que lo protege de corrosión adicional. La galvanización se realiza por inmersión del hierro en zinc fundido. El zinc también puede ser electrochapado sobre piezas de hierro, dándole una superficie galvanizada más suave. El hierro "Sherardized" se forma por recubrimiento del hierro con una aleación de hierro-zinc y luego horneado a 800°C. El revestimiento de zinc sobre hierro ofrece protección, incluso si la capa de zinc se rompe por medio de protección catódica. El zinc tiene un potencial de reducción más negativo (-0,76 V) que el hierro (-0,04 V), y por lo tanto actúa como un ánodo y se oxida con preferencia al hierro.
El zinc se utiliza en la fabricación de aleaciones como el latón (la aleación con cobre). El zinc se utiliza como el electrodo exterior en las pilas secas. Se usó en las primeras células fotovoltaicas, tales como la célula Daniell.
El sulfato de zinc se utiliza como desinfectante y como pigmento blanco en pinturas.
El óxido de zinc (ZnO) también se utiliza como pigmento llamado blanco de zinc, y se utiliza en antisépticos (ungüento de óxido de zinc para las quemaduras). El óxido de zinc se utiliza en la fabricación de caucho para mejorar las características mecánicas del producto. Se utiliza como constituyente de las superficies fotoconductoras en fotocopiadoras. El zinc se encuentra con manganeso y hierro en el mineral de óxido franklinita. Acompañando a la franklinita puede estar el mineral de óxido de zinc con calcio, hardystonita. Un óxido de zinc con manganeso es la hetaerolita.
El mineral de zinc más común es la esfalerita, ZnS. El zinc metálico se produce por la primera tostación del mineral en aire para formar su óxido
2ZnS(s) + 3O2(g) -> 2ZnO(s) + CO(g).
Luego, se reduce el óxido de zinc por calentamiento con coque (carbón,) que produce el vapor de metal. El vapor se condensa en forma líquida y se enfría para formar el metal sólido
ZnO(s) + C(s) -> Zn(g) + CO(g).
El hecho de que la temperatura requerida para la reducción esté por encima del punto de ebullición del zinc (907°C) retrasó el descubrimiento del zinc. Reducciones similares se utilizaron para preparar el cobre, el plomo y el hierro incluso en la antigua Roma. El zinc también fue probablemente producido, pero se perdió en la vaporización. El latón se formó varios siglos antes del descubrimiento de zinc como metal puro (el latón es una mezcla de cobre y zinc).
Además de la esfalerita, el zinc se une con el hierro para formar el sulfuro wurtzita, (Zn,Fe)S. Otro mineral de zinc de origen natural es un mineral de carbonato llamado smithsonita. El mineral bayldonita que combina cobre, zinc y plomo con un grupo arseniato, exhibe un llamativo color verde. Otro mineral de zinc verde es el arseniato de zinc adamita, Zn2AsO4(OH). Hay un dimorfo de adamita llamado paradamita. El arseniato de zinc legrandita tiene la misma fórmula empírica que la adamita, excepto la adición del agua de hidratación, y tiene un intenso color naranja. El mineral de arseniato de zinc reinerita, Zn3(AsO3)2, carece de color intenso.
El zinc forma el silicato willemita, Zn2SiO4, que también puede producir cristales de color verde. El zinc también forma el silicato hemimorfita (calamina). El zinc con manganeso forma el silicato hodgkinsonita. El zinc con magnesio, manganeso y arsénico forma el silicato mcgovernita. El zinc con aluminio forma el mineral de óxido gahnita. El zinc se encuentra con manganeso y hierro en el mineral calcofanita. El óxido con plomo y vanadio es la descloizita. El óxido de zinc con el cobre, vanadio y plomo es la mottramita.
|