Elementos de Transición
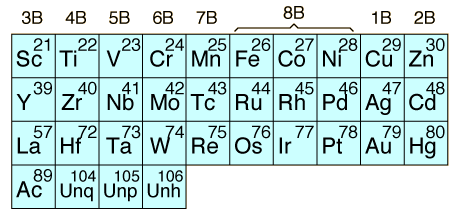
Los elementos de transición son aquellos que tienen la subcapa d o f parcialmente llena en cualquier estado de oxidación común. El término "elementos de transición" se refiere más comúnmente a los elementos de transición del bloque d. Los elementos 2B, zinc, cadmio y mercurio no cumplen estrictamente las características que los definen, pero normalmente se incluye con los elementos de transición, debido a sus propiedades similares. Los elementos de transición del bloque f son a veces conocidos como "elementos de transición interna". La primera fila de ellos se llama lantánidos o tierras raras. La segunda fila se compone de los actínidos. Todos los actínidos son radiactivos y los que están por encima de Z=92 están hechos por el hombre en los reactores nucleares o aceleradores.
Las propiedades generales de los elementos de transición son:
- Por lo general son metales de alto punto de fusión.
- Tienen varios estados de oxidación.
- Generalmente forman compuestos coloreados.
- A menudo son paramagnéticos
Los elementos de transición incluyen los importantes metales hierro, cobre y plata. El hierro y el titanio son los elementos de transición más abundantes. Muchos catalizadores para las reacciones industriales implican elementos de transición.
| Química de los Elementos |
Tabla Periódica
Conceptos de Química
Referencia
Ebbing
Cap. 23
| HyperPhysics | M Olmo R Nave |