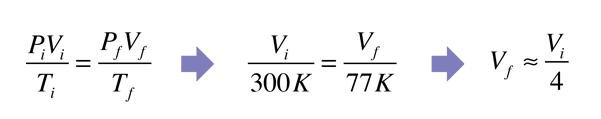Ley de Gas Ideal y Reducción de un Globo en Nitrógeno Líquido

| |

| La aplicación de la ley de gas ideal, al gas que está por encima del nitrógeno líquido en un termo, indica que el volumen de un globo colocado sobre él, se reducirá a una cuarta parte. En realidad, se reduce mucho más que eso - la eliminación de prácticamente todo el gas en el globo.
|
La expectativa de la ley del gas ideal se resume en
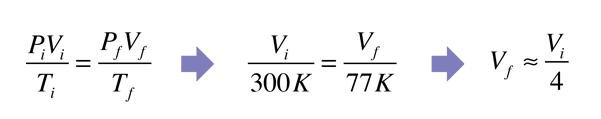
Un paso para la explicación de la reducción del volumen, es el hecho de que toda la humedad del aire se congela. Pero la humedad, incluso en el aire saturado a temperatura corporal (de haber estado soplando el globo para inflarlo), proporciona una presión de vapor de solamente 47 mmHg, es decir; una reducción en volúmen de solo un 6% del total. La siguiente sugerencia es que el oxígeno del aire se condensa. El punto de ebullición del oxígeno es 90ºK en comparación con los 77ºK del nitrógeno, por lo que se espera que se condense todo. Sin embargo, el contenido de oxígeno del aire es sólo el 21% o alrededor de 159 mmHg, por lo que no es suficiente para explicar el colapso que observamos casi completo del globo.
Por consiguiente está claro que para poder explicar el grado de colapso que observamos en el experimento de la película, la mayor parte del nitrógeno contenido en el aire interior del globo se licúa. La respuesta a esto no está tan clara. El aire en el globo está a una elevada presión, y el aumento de la presión elevará la temperatura del punto de ebullición a la que se puede licuar el gas, pero eso aparenta ser un efecto pequeño. Parece que la explicación principal viene del hecho de que el aire es una mezcla y que la licuefacción del aire ocurre a una temperatura mas alta que la del gas nitrógeno puro, alrededor de 79ºK a la presión atmosférica.
Hay aún algun misterio mas en el comportamiento del globo en nitrógeno líquido. Puesto que la ley de Pascal dictamina que todos los puntos dentro del globo tienen la misma presión, entonces sabemos que cuando ponemos un extremo del globo en el nitrógeno líquido, empieza a encogerse, mientras que el otro extrema que tenemos en la mano, todavía aparece de tamaño normal, por tanto la presión interna en este extremo no ha cambiado significativamente. La ley de Laplace nos da una relación entre el radio del globo y la presión interna, de modo que, tanto como se mantenga un trozo de globo en el aire y cerca de su tamaño normal, se está manteniendo la misma presión interna en esa parte del globo. De la cantidad de globo que hemos conseguido colapsar, extraemos la siguiente información: hemos cogelado el contenido de agua procedente de la humedad del aire, hemos licuado el oxígeno propio del aire, y se ha empezado a licuar el nitrógeno tambien del interior del globo. En este punto, tengo en mente algunas dudas -la inflación aún de parte del globo, supone una presión interna por encima de la atmosférica, pero no sé cuanta presión se necesita.
Durante estos procesos extremos, el material del globo ha continuado siendo muy hermético, como lo prueba el hecho de que podemos enfriarlo y calentarlo varias veces, sin cambio aparente de su tamaño en volumen.
|
Índice
Conceptos sobre Temperatura
Nitrógeno Líquido |