Células Voltaicas
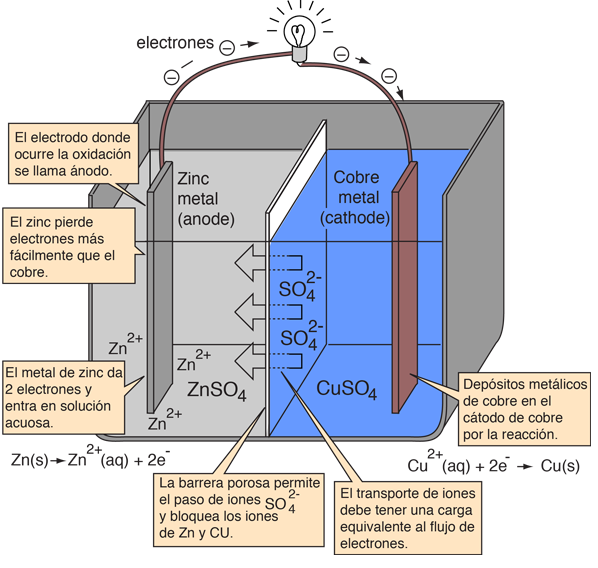
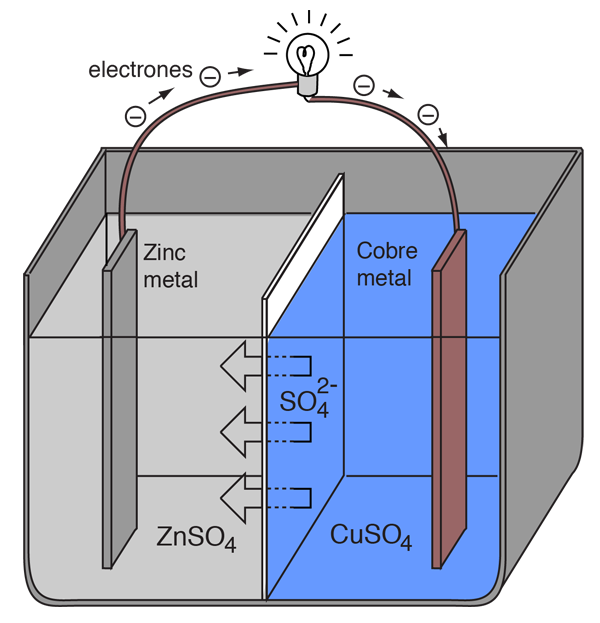
Se puede crear una célula electroquímica que origine un flujo de corriente eléctrica externa, usando cualesquiera de dos metales diferentes, ya que los metales se diferencian en su tendencia a perder electrones. El zinc pierde electrones más fácilmente que el cobre, por lo que la colocación de metales zinc y cobre en soluciones de sus sales, pueden hacer que los electrones fluyan a través de un cable externo. La conducción se hará desde el zinc hasta el cobre.
| Agregar Anotación a la Ilustración |
Cuando un átomo de zinc proporciona electrones, se convierte en un ion positivo y pasa a la solución acuosa, disminuyendo la masa del electrodo de zinc. En el lado del cobre, los dos electrones recibidos, le permite convertir un ion de cobre de la solución en un átomo de cobre sin carga, que se deposita sobre el electrodo de cobre, aumentando su masa. Las dos reacciones se escriben típicamente
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Las letras en paréntesis son sólo recordatorios de que el zinc va desde un sólido (s) a una solución de agua (aq) y viceversa para el cobre. Es típico en el lenguaje de la electroquímica, referirse a estos dos procesos como "reacciones-medias" que se producen en los dos electrodos.
Zn(s) -> Zn2+(aq) + 2e- |
|
|
Cu2+(aq) + 2e- -> Cu(s) |
A fin de que la célula voltaica continue produciendo una corriente eléctrica externa, debe haber un movimiento de los iones de sulfato en la solución, desde la derecha hacia la izquierda, para equilibrar el flujo de electrones en el circuito externo. Los propios iones metálicos deben estar impedidos de moverse entre los electrodos, por lo que debe proporcionarse algún tipo de membrana porosa o de otro mecanismo, para el movimiento selectivo de los iones negativos en el electrolito desde la derecha a la izquierda.
Para obligar a que los electrones se muevan desde el zinc al electrodo de cobre, se necesita energía, y la cantidad de energía por unidad de carga disponible a partir de la célula voltaica se llama fuerza electromotriz (fem) de la célula. La energía por unidad de carga se expresa en voltios (1 voltio = 1 julio/culombio).
Evidentemente, para obtener energía de una pila o batería, se debe liberar más energía en la oxidación del zinc que la que se necesita para reducir el cobre. A partir de este proceso, la batería puede producir una cantidad finita de energía, el proceso está limitado por la cantidad de material disponible, ya sea en el electrólito o en los electrodos metálicos. Por ejemplo, si hubiera un mol de iones de sulfato SO42- en el lado del cobre, entonces el proceso está limitado a la transferencia de dos moles de electrones a través del circuito externo. La cantidad de carga eléctrica contenida en un mol de electrones se denomina constante de Faraday, y es igual al número de Avogadro por la carga del electrón:
El rendimiento de energía de una célula voltaica está dada por el voltaje de la célula multiplicado por el número de moles de electrones transferidos, por la constante de Faraday.
Energía eléctrica producida = nFEcell
La fem de la célula, Ecell se puede predecir de los potenciales de electrodos estándares de los dos metales. Para la célula de zinc/cobre bajo condiciones estándares, el potencial de célula calculado es 1,1 voltios.
| Pilas Secas | Baterías de Plomo-Ácido |
Conceptos de
Conceptos de Electroquímica
Referencias
Hill & Kolb
Cap. 8
Ebbing
Cap. 19
| HyperPhysics*****Electricidad y Magnetismo*****Química | M Olmo R Nave |