Potenciales de Electrodo y Constantes de Equilibrio
El potencial de una célula voltaica, es una medida de la cantidad máxima de energía por unidad de carga que está disponible para realizar trabajo, cuando la carga se transfiere a través de un circuito externo. Este trabajo máximo es igual al cambio en la energía libre de Gibbs, ΔG, en la reacción. Estas relaciones se pueden expresar como
Trabajo máximo = ΔG = -nFE°célula
donde n es el número de electrones transferidos por mol y F es la constante de Faraday.
Este cambio de energía libre también puede estar relacionado con la constante de equilibrio K
ΔG = -RT ln K
La combinación de estas relaciones nos permite expresar el potencial de célula en términos de la constante de equilibrio.
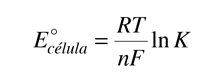
Considérese la histórica pila Daniell en el que se utilizaban zinc y cobre como electrodos. Los datos de la tabla de potenciales de electrodo estándar es
| Cátodo (reducción) Semirreacción | Potencial estándar E°(voltios) |
| Zn2+(aq) + 2e- → Zn(s) | |
| Cu2+(aq) + 2e- → Cu(s) |
El potencial de célula estándar es entonces E°célula = 1,1 voltios y se transfieren 2 electrones por mol de reactivo. La relación de la constante de equilibrio es entonces

Este extremadamente alto valor de la constante de equilibrio confirma que la reacción de la célula de Daniell es de hecho espontánea, y que va a proseguir hasta que se agoten los reactivos.
| Tabla de Potenciales de Electrodos Estándares |
Conceptos de
Oxidación/
Reducción
Conceptos de Electronegatividad
Referencias
Hill & Kolb
Cap. 8
Ebbing
Cap. 19
| HyperPhysics*****Electricidad y Magnetismo*****Química | M Olmo R Nave |