Cisteína
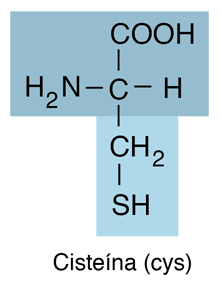 |
La cisteína es un aminoácido y pertenece a la clase que tiene grupos R neutros. Es hidrofílica. La cadena lateral de tiol en la cisteína a menudo participa en reacciones enzimáticas como nucleófilo. El tiol es susceptible de oxidarse para dar cistina, un derivado disulfuro, que desempeña un papel estructural importante en muchas proteínas. |
Junto con la metionina, la cisteína es uno de los dos aminoácidos proteinogénicos que contienen azufre.
La cisteína es una fuente importante de sulfuro en el metabolismo humano. El sulfuro en los grupos de hierro-azufre y en la nitrogenasa se extrae de la cisteína, que se convierte en alanina en el proceso.
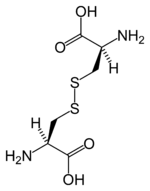 |
Dos moléculas de cisteína pueden unirse para formar cistina con un enlace disulfuro. En las estructuras de proteínas, los enlaces disulfuro entre cisteínas de puntos separados en el polipéptido pueden influir en la flexión y la forma de la proteína. La insulina es un ejemplo de una proteína con tal reticulación de cistina. |
| Wiki cisteína |
Conceptos de Bioquímica
Conceptos de Química
Referencia
Tillery, Enger and Ross
Cap. 14
Ahern
| HyperPhysics*****Química*****Química Orgánica | M Olmo R Nave |