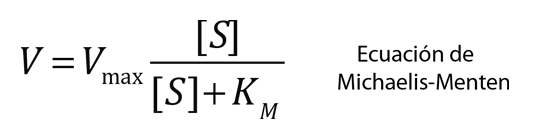Regulación de Reacciones Enzimáticas
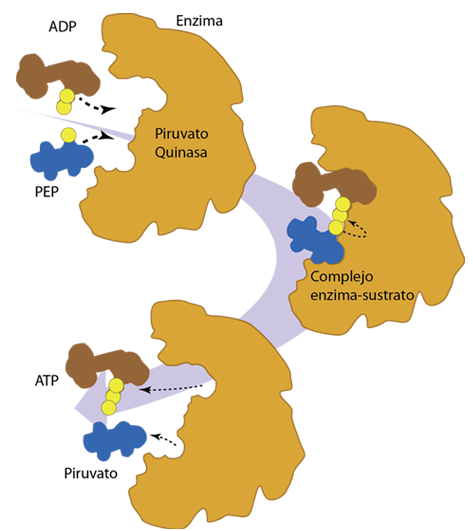
La asombrosa velocidad de las reacciones catalizadas por enzimas permite que las reacciones bioquímicas necesarias operen a la "velocidad de la vida", segun cita Ahearn. Pero no se debe permitir que tales reacciones operen a toda velocidad continuamente, sino que deben responder al nivel de necesidad en las condiciones variables de las células vivas.
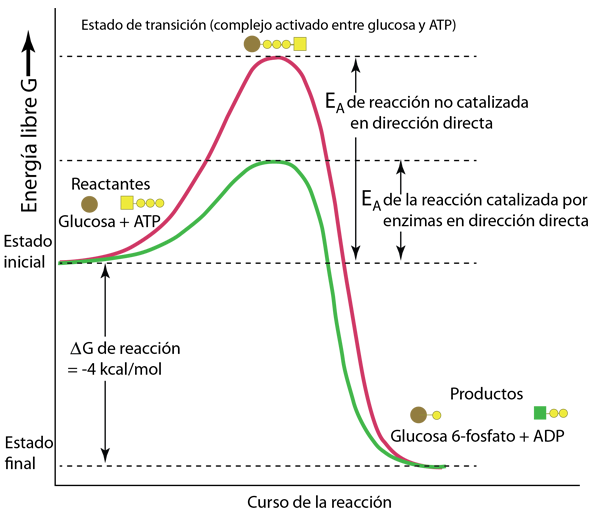
Las reacciones catalizadas por enzimas se pueden describir en términos de la tasa o velocidad de formación del producto en función de la concentración del sustrato suministrado.
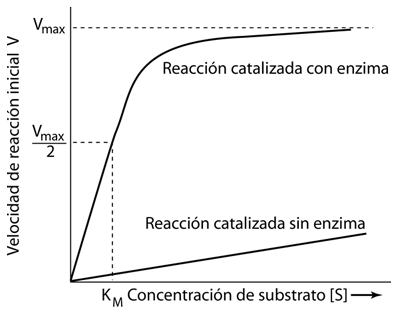 |
Utilizando la notación de Karp, la variable V representa la "velocidad" de la reacción, definida como el número de moles de producto formado por segundo. Vmax es entonces la tasa máxima de producción a medida que la cantidad de sustrato [S] suministrado se acerca a la saturación. También se utiliza el "número de rotación", el número máximo de moléculas de sustrato que una molécula de enzima puede convertir en producto por segundo. |
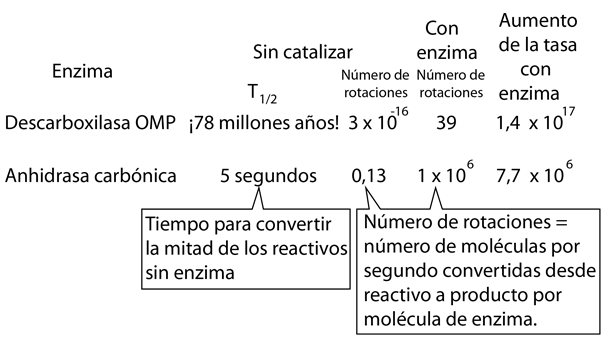
El número de rotación también se denomina constante catalítica, kcat. Si bien los números de recambio típicos pueden estar en el rango de 1 a 1000, ¡la notable enzima anhidrasa carbónica puede llegar a 106!.
Otro término utilizado en la descripción de la catálisis es el valor de la concentración de sustrato [S] que está asociado a una velocidad V igual a la mitad de la máxima Vmax/2. Este valor se llama KM y se denomina constante de Michaelis. Se puede usar en una relación para la velocidad de reacción V llamada ecuación de Michaelis-Menten, que se puede usar para producir el gráfico descriptivo anterior.
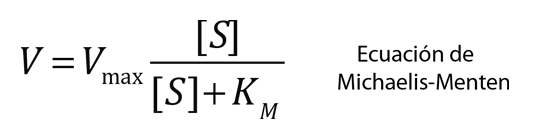
| Otra forma utilizada para mostrar la reacción enzimática que tiene algunas ventajas es el diagrama de Lineweaver-Burk. Traza el recíproco 1/V de la velocidad frente al recíproco de la concentración de sustrato 1/[S]. El valor de Vmax se puede encontrar a partir de la intersección con el eje vertical y el valor de KM se puede obtener a partir de la intersección con el eje horizontal. Este gráfico proporciona una ventaja si se recopilan algunos valores experimentales, ya que los valores a lo largo de una línea recta se pueden extrapolar fácilmente para obtener un valor de KM. |
 |
Los gráficos anteriores se pueden usar para evaluar los efectos de los inhibidores de enzimas que se usan para regular la salida del producto a niveles apropiados para satisfacer las necesidades de una célula. Los inhibidores de enzimas generalmente toman la forma de moléculas que se unen a la enzima para disminuir su producción. Los inhibidores de enzimas pueden fabricarse como medicamentos, antibióticos o pesticidas, ya que pueden usarse para controlar procesos bioquímicos no deseados.
Los inhibidores competitivos son moléculas que se unen débilmente a la enzima y, por lo tanto, son reversibles, pero actúan para disminuir la actividad de la enzima compitiendo por el sitio activo de la enzima. Los sitios activos en las enzimas suelen tener alguna forma de geometría complementaria que se adapta al sustrato, por lo que los inhibidores competitivos pueden compartir algunas de esas características geométricas para que puedan competir para unirse a la enzima. Tal inhibición competitiva es la base para el diseño de muchas drogas comunes.
Los inhibidores no competitivos son inhibidores reversibles que se unen a un sitio diferente de la enzima y, por lo tanto, no compiten por unirse al sitio activo normal. En este caso, la cantidad de inhibición solo depende de la concentración del inhibidor y el aumento de la cantidad de sustrato no la superará. Como se muestra en los gráficos a continuación, la inhibición no competitiva reducirá la Vmax alcanzable. La inhibición competitiva permite alcanzar una Vmax comparable a la Vmax no inhibida, pero requerirá una mayor concentración de sustrato [S].
Los inhibidores irreversibles son agentes que se unen fuertemente a una enzima, formando a menudo enlaces covalentes con uno de los aminoácidos contenidos en la enzima. Dichos inhibidores pueden detener por completo un proceso bioquímico y formar fármacos o venenos potentes. Algunos gases nerviosos y pesticidas organofosforados actúan como inhibidores irreversibles de la acetilcolinesterasa.. Esa enzima normalmente descompone la acetilcolina que estimula la contracción muscular. Con esa enzima bloqueada, la acetilcolina sigue estimulando al músculo para que permanezca en estado de contracción permanente. El antibiótico penicilina actúa como un inhibidor irreversible de una enzima clave en la formación de la pared celular bacteriana.
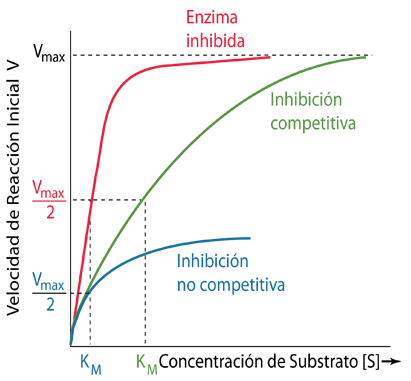 | Los efectos de los inhibidores reversibles se muestran tanto para la inhibición competitiva como para la no competitiva en comparación con la enzima no inhibida. Téngase en cuenta que para la inhibición competitiva, la velocidad V puede acercarse a la misma Vmax que la enzima no inhibida, pero requiere una concentración de sustrato más alta [S]. Para la inhibición no competitiva, se alcanza una Vmax más baja ya que el agente inhibidor cambia la enzima en una ubicación diferente al sitio activo del sustrato. |
| El uso de la gráfica de Lineweaver-Burk de los efectos de diferentes inhibidores reversibles genera gráficas de las inversas de V y [S]. El inhibidor no competitivo reduce la Vmax sin afectar la KM, mientras que el inhibidor competitivo aumenta la KM sin afectar la Vmax. | 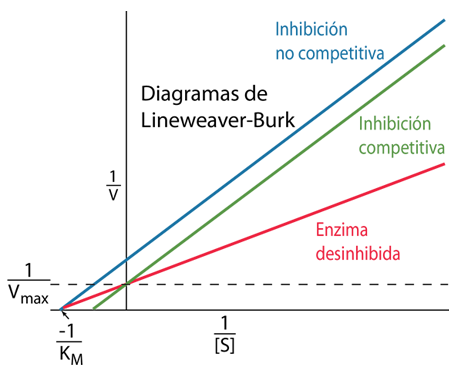 |
| Índice
Conceptos de Bioquímica
Conceptos de Química
Karp
Cap. 3.2
Ahearn
Cap. 7 |