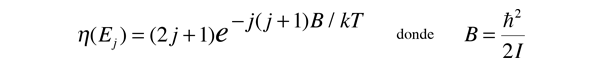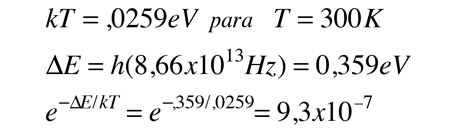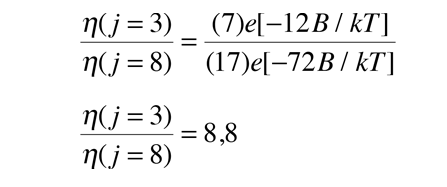Espectro de Vibración-Rotación del HCl
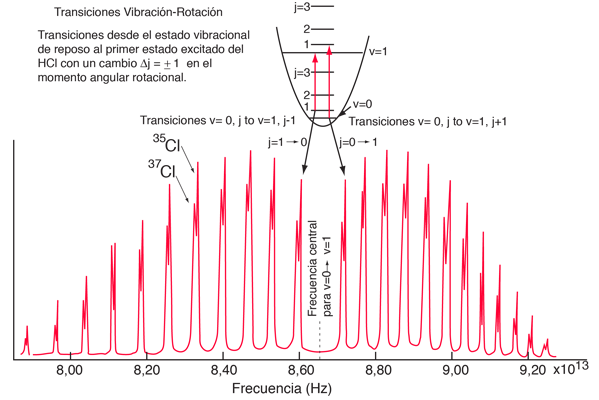
Para obtener información sobre la rotación y la vibración de las moléculas, se puede analizar un clásico entre los espectros moleculares, el espectro de absorción infrarroja del HCl.
Las líneas de absorción que se muestran implican transiciones desde el estado fundamental al primer estado de vibración excitado del HCl, y también implican cambios en el estado de rotación. Durante tales transiciones, el momento angular de rotación cambia en 1. Si se tuviera una transición desde j=0 en el estado de vibración fundamental a j=0 en el primer estado excitado, produciría una línea en la energía de transición vibracional. Como se observa, se obtienen series estrechamente espaciadas de líneas que van hacia arriba y hacia abajo de esa diferencia de nivel vibracional. El desdoblamiento de las líneas muestra la diferencia en la inercia de rotación de los dos isótopos del cloro, Cl-35(75,5%) y Cl-37(24,5%).
Del espectro de arriba, se pueden examinar detalles sobre lo siguiente:
|
|
|
|
|
|
|
|
Conceptos de Espectro Molecular
Referencia
Tipler & Llewellyn
Sec. 9-4