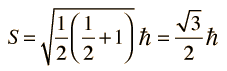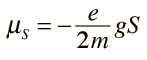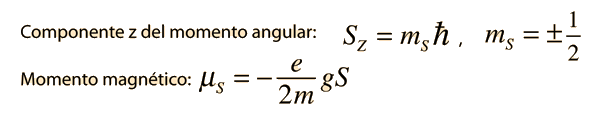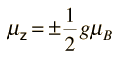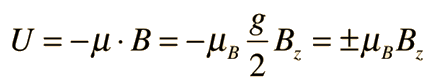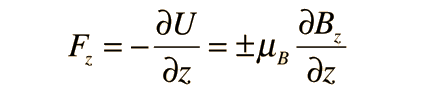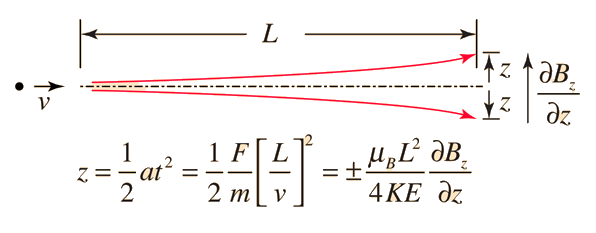Experimento de Stern-Gerlach
En 1921, Otto Stern y Walter Gerlach realizaron un experimento que demostró la cuantización del espín del electrón en dos orientaciones. Esto supuso una contribución fundamental al desarrollo de la teoría cuántica del átomo.
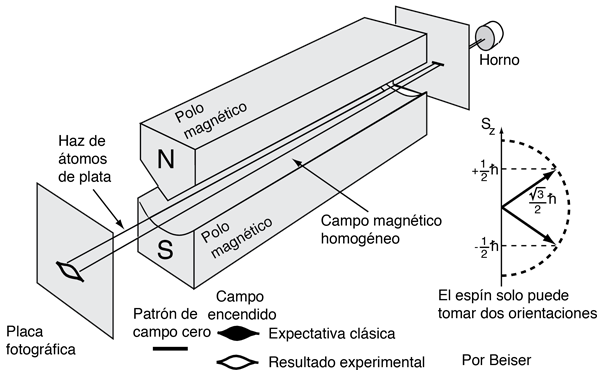
El experimento real se llevó a cabo con un haz de átomos de plata de un horno caliente, ya que estos pueden ser fácilmente detectados, usando una emulsión fotográfica. Los átomos de plata permitieron a Stern y Gerlach estudiar las propiedades magnéticas de un solo electrón, porque estos átomos tienen un simple electrón exterior, que se mueve en el potencial de Coulomb originado por los 47 protones del núcleo, apantallado por los 46 electrones internos. Dado que este electrón tiene un momento angular orbital cero (número cuántico orbital l=0), se podría esperar que no existiera interacción con un campo magnético externo.
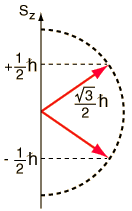
Stern y Gerlach dirigieron el haz de átomos de plata dentro de una región de campo magnético no uniforme (véase el esquema del experimento). Un momento dipolar magnético experimentará una fuerza proporcional al gradiente de campo, puesto que los dos "polos" estarán sujetos a campos diferentes. Clásicamente, se podría esperar todas las orientaciones posibles de los dipolos, de modo que se produjera una mancha continua en la placa fotográfica, pero encontraron que el campo separaba el haz en dos partes distintas, lo que indica que solamente había dos posibles orientaciones del momento magnético del electrón.
¿Pero cómo obtiene el electrón un momento magnético, si tiene un momento angular cero, y por lo tanto no produce "bucle de corriente", que produzca a su vez un momento magnético?. En 1925, Samuel A. Goudsmit y George E. Uhlenbeck postularon que el electrón tenía un momento angular intrínseco, independiente de sus características orbitales. En términos clásicos, una bola de carga podría tener un momento magnético si estuviera girando de tal manera, que la carga en los bordes produjera un bucle de corriente efectiva. Este tipo de razonamiento llevaron a la utilización del "espín electrónico", para describir el momento angular intrínseco.
|
Índice
Grandes Experimentos de Física
ReferenciaRohlf, Sec 8.4 |