El Agua
|
Además de ser esencial para la vida, el agua es una sustancia extraordinaria con muchas propiedades sorprendentes. Es el único líquido inorgánico que se da de forma natural en la Tierra, y el único compuesto químico que se produce de forma natural en los tres estados físicos. |
| El agua tiene el calor específico más alto de todas las sustancias comunes, 1 caloría/g °C = 4,186 J/g °C. Esto proporciona la estabilidad de la temperatura en las masas de tierra rodeadas de agua, proporciona la estabilidad de la temperatura del cuerpo humano, lo convierte en un agente refrigerante efectivo, y muchos otros beneficios. El alto calor de vaporización del agua, la convierte en un refrigerante eficaz para el cuerpo humano a través de la evaporación de la transpiración, ampliando la gama de temperaturas en las que pueden existir los seres humanos. |
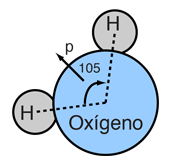
A la derecha se tiene un modelo a escala de una molécula de agua, en base a la longitud de enlace experimental y ángulo, en la fase de gas, a partir de datos espectroscópicos. Los tamaños de las esferas que representan los átomos están a escala de sus radios covalente en la tabla periódica. Aunque los números para el ángulo y la longitud de enlace representan la alta precisión de la espectroscopia en fase gaseosa de moléculas aisladas, no se presume que las moléculas de agua esten bloqueadas rígidamente en esa configuración. Están en incesante rotación y vibración, además de las altas velocidades lineales asociadas con la energía térmica a temperaturas ordinarias. |
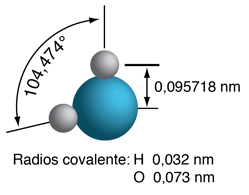 |
En general, el movimiento de vibración molecular se lleva a cabo en una escala de tiempo más corta que la rotación, pasando a través de muchos ciclos de vibración durante un período de rotación, de manera que las longitudes de los enlaces obtenidos a partir de los espectros de rotación molecular, son longitudes de enlace promedio efectivas. Los parámetros de la molécula de agua aislada de arriba se alteran significativamente en agua líquida, y más aún en los cristales de hielo hexagonales. Las moléculas de agua tienen grandes momentos dipolares y el enlace de hidrógeno que resulta en el estado líquido, altera el ángulo de enlace a algo así como 105,5 a 106°, con una longitud de enlace alrededor de 0,097 nm. En los cristales de hielo hexagonales, el ángulo de enlace se acerca al ángulo tetraédrico, 109,47 °. Además de todos los movimientos moleculares, en el agua líquida existe un continuo intercambio de átomos de hidrógeno entre las moléculas de agua - alrededor de un intercambio por milisegundo a un pH neutro de 7,0, y más rápidamente cuando el pH se aparta de la neutralidad.
El agua proporciona el estándar de densidad de 1 gramo/cm3.
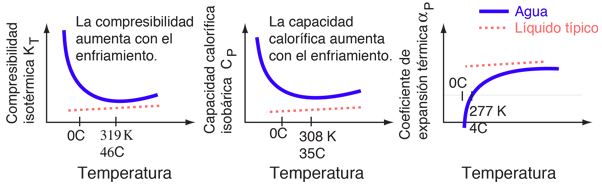
Aunque el agua puede parecer un líquido ordinario, sus propiedades son de muchas maneras inusuales. Los cambios en las propiedades del agua cerca de su punto de congelación, se ilustran a continuación con dibujos adaptados de Debenedetti and Stanley. Las escalas verticales están exageradas para enfatizar - las magnitudes reales de los cambios son bastante pequeñas -. Lo que la hace notable es el contraste con las propiedades de otros líquidos.
| Fases del Agua | Calor Específico | Tensión de Superficie |
| Momento Dipolar | Enlace Dipolar | Disponibilidad en la Tierra |
Referencias del agua:
Franks, F., Water: A Matrix of Life, 2nd Ed., Royal Society of Chemistry,Cambridge, UK (2000).
Ball, P., Life's Matrix: A Biography of Water, Farrar, Straus, and Giroux, New York (2000).
Conceptos del Agua
Conceptos de Química
| HyperPhysics*****Química | M Olmo R Nave |