Hemoglobina y Mioglobina
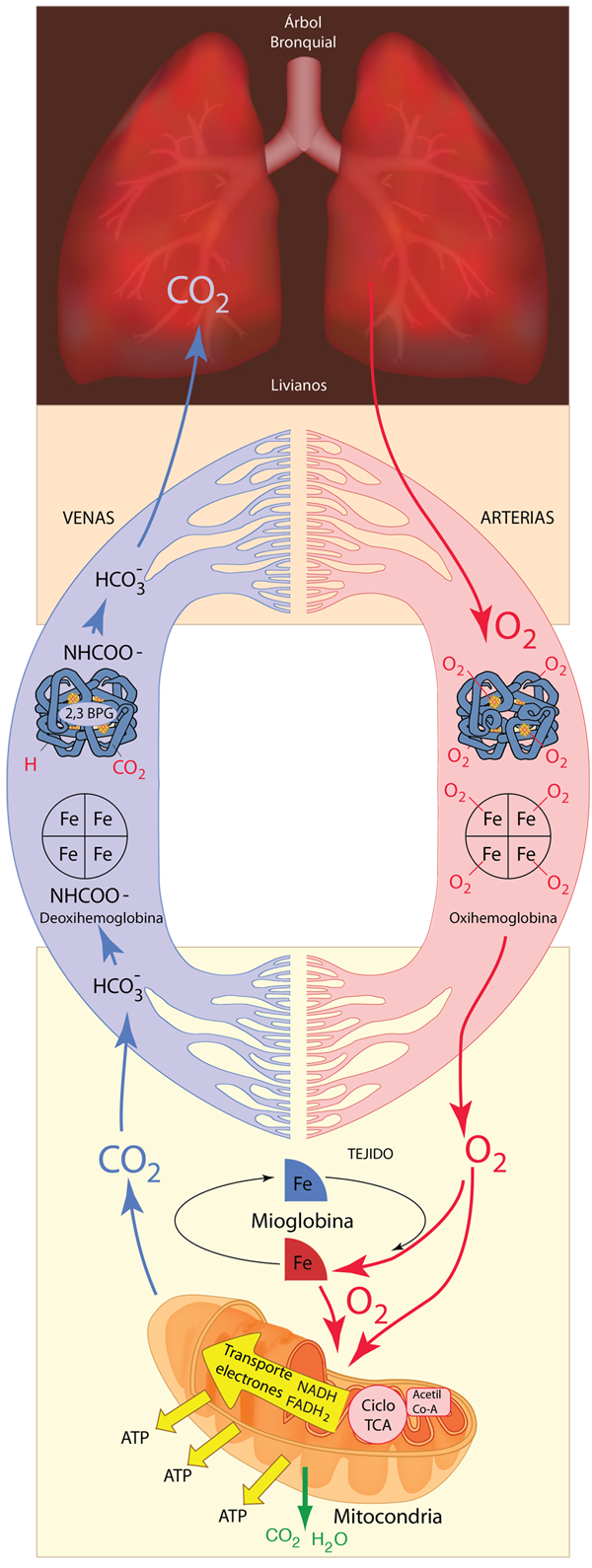
El sistema respiratorio debe proporcionar un suministro continuo de oxígeno a todas las partes del cuerpo. El oxígeno es necesario para el metabolismo en todo el cuerpo y el destino final de su viaje es el proceso de proporcionar energía en forma de ATP para todas las partes de los procesos del cuerpo. Como se muestra a continuación, el proceso que comienza en los pulmones utiliza una proteína de transporte llamada hemoglobina para transportar el oxígeno a los tejidos y también hace un uso extensivo de otra proteína, la mioglobina, para el almacenamiento de energía. La hemoglobina es transportada por los glóbulos rojos en la sangre. El oxígeno se transporta a las mitocondrias en las células donde la cadena de transporte de electrones finalmente coloca el oxígeno en las moléculas de agua, para ser exhalado.
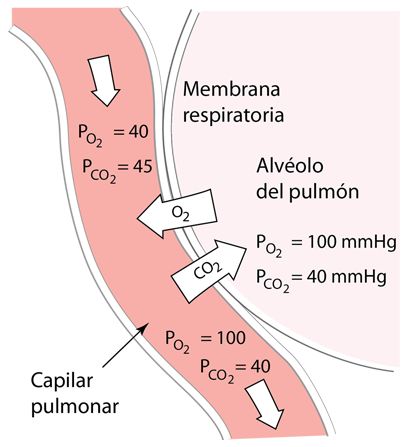 |
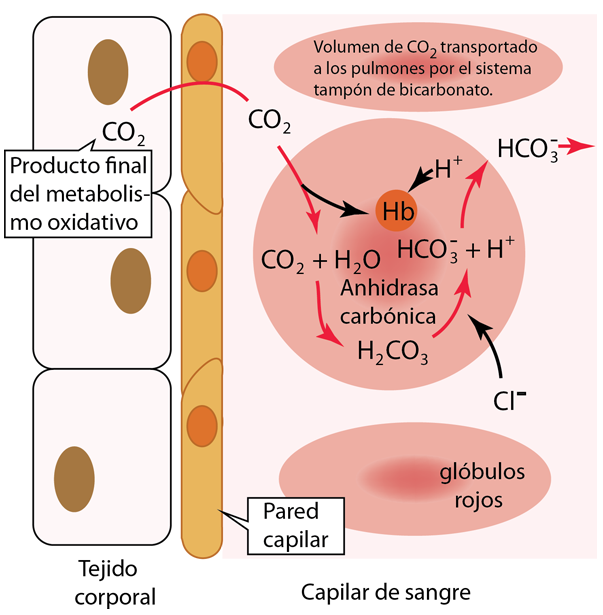
El oxígeno de los pulmones se difunde hacia los capilares pulmonares y hacia los glóbulos rojos para unirse a la hemoglobina. Este proceso de difusión del intercambio de gases depende de las presiones parciales y la solubilidad en los fluidos y se describe con más detalle en la ley de Fick, la ley de Graham y la ley de Henry . Al mismo tiempo que el oxígeno se difunde preferentemente en la sangre, hay una difusión neta de CO2 de la sangre a los pulmones, para ser exhalado. |
La hemoglobina es una proteína esencial en el cuerpo, que realiza la mayor parte del transporte de oxígeno en la sangre. La hemoglobina contiene hierro que le da un color rojo y aporta ese color a los glóbulos rojos y a la sangre misma.
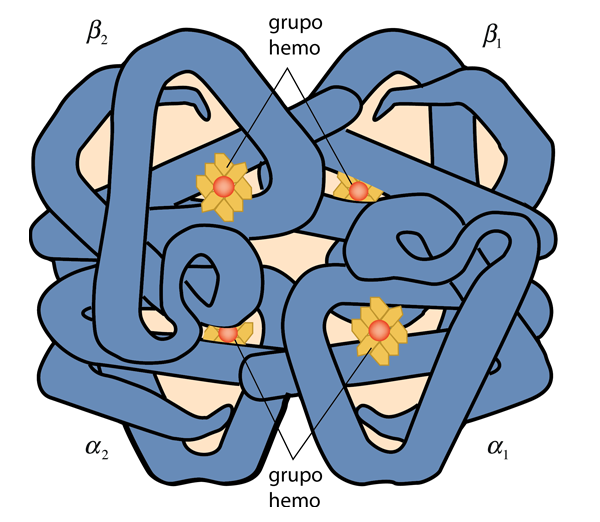
La hemoglobina consta de dos tipos de componentes llamados hemo y globina. La globina es una proteína de 574 aminoácidos en cuatro cadenas polipeptídicas. Cada una de esas cadenas está asociada con un grupo hemo. Cada grupo hemo rodea un átomo de hierro y cada átomo de hierro puede unirse libremente con un átomo de oxígeno. Al unirse hasta con cuatro moléculas de oxígeno, la hemoglobina forma el compuesto llamado oxihemoglobina. La mioglobina consta de una cadena polipeptídica similar a una de las cuatro en la estructura anterior y puede unirse solo a una molécula de oxígeno. Es abundante en las células musculares y actúa como un lugar de almacenamiento de oxígeno al que la célula recurre en momentos de bajo suministro de oxígeno.
Cualquier animal de más de unos pocos milímetros de tamaño debe garantizar un suministro constante de oxígeno a las células de todo su cuerpo y eliminar los productos de desecho como el dióxido de carbono. En todos los vertebrados e incluso en alguna vida microscópica, la proteína de transporte es la hemoglobina. La mayoría de los animales también utilizan la mioglobina en el tejido muscular para proporcionar una reserva de oxígeno durante períodos de alta demanda de oxígeno.
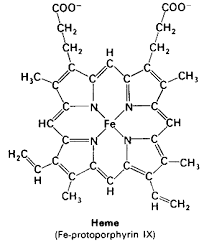 |
Un átomo de hierro en el estado FeII forma una porfirina de hierro que proporciona el color rojo vivo a la sangre y los glóbulos rojos. Las plantas usan una porfirina de magnesio en la clorofila que le da a las plantas su color verde. Esta porfirina de hierro se une a las proteínas para proporcionar el sitio de unión al oxígeno. |
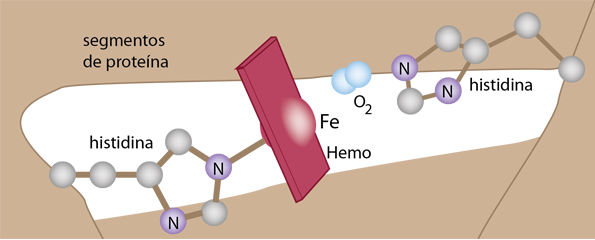
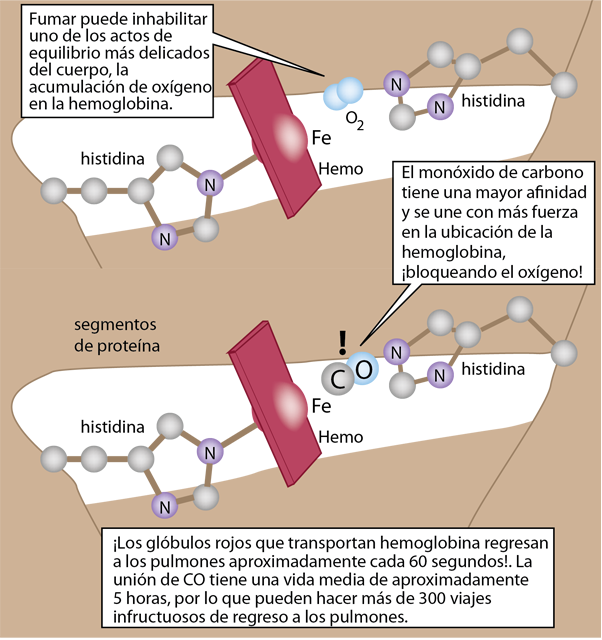
Los detalles del entorno polipeptídico de la mioglobina y la hemoglobina se unen al oxígeno pero protegen al hierro de la oxidación. Este ambiente exquisitamente equilibrado permite que el oxígeno se una y se libere para que pueda unirse a otro oxígeno. El marco para sostener el hemo incluye dos histidinas que ayudan a estabilizar el hemo en una bolsa de la estructura globular de mioglobina o hemoglobina.
La bolsa de hemo es ideal para el oxígeno, pero el monóxido de carbono en realidad se une tanto a la hemoglobina como a la mioglobina con una afinidad mucho mayor y esa unión no es fácilmente reversible. Esto hace que el CO sea un potente veneno en el cuerpo.
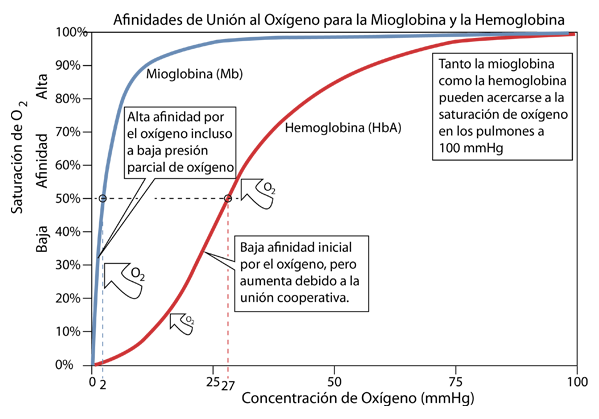
Cuando se le proporciona un suministro de oxígeno, la mioglobina se unirá al oxígeno rápidamente incluso a presiones parciales de oxígeno muy bajas. Eso lo hace eficiente como lugar de almacenamiento de oxígeno, pero este tipo de curva de afinidad lo convierte en un pobre proveedor de oxígeno a valores típicos de presión parcial en los tejidos. La afinidad de la hemoglobina comienza baja y aumenta gradualmente hasta una presión parcial de suministro de aproximadamente 20 mmHg, pero luego aumenta bruscamente. Este cambio en su comportamiento (un efecto alostérico) se debe al hecho de que la unión de una molécula de oxígeno al primero de los cuatro hemos provoca un cambio de configuración en la hemoglobina que le facilita la unión del oxígeno a los otros tres hemos. A esto se le llama "enlace cooperativo" y es de enorme importancia en la eficiencia del transporte de oxígeno en los animales.
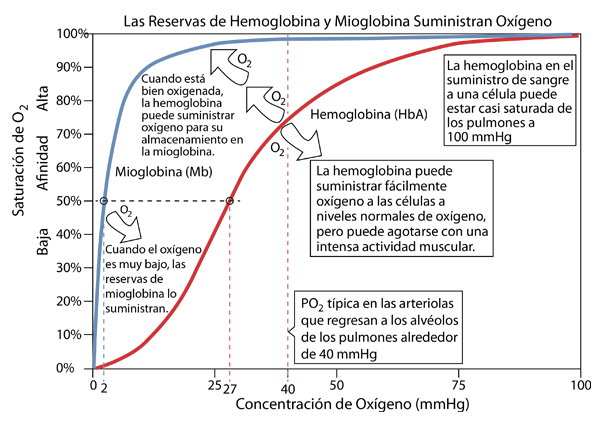
La mioglobina en el tejido, especialmente en el tejido muscular, acepta oxígeno de la hemoglobina y lo almacena. Luego puede entregar el oxígeno a las mitocondrias cuando sus necesidades de oxígeno sean lo suficientemente grandes.
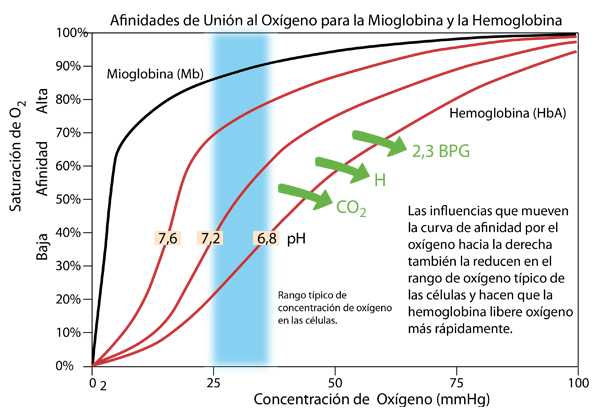
El pH de la sangre está cerca del pH neutro de 7,4, normalmente oscila entre 7,35 y 7,45 y debe mantenerse en ese rango. Pero dentro de las células, el pH puede variar en un rango más amplio y afecta el proceso de suministro de oxígeno. Si el pH se vuelve más bajo (más ácido), la curva de afinidad de oxígeno de la hemoglobina se mueve hacia la derecha como se muestra arriba, y exhibe una menor afinidad en el rango de concentración de oxígeno típico del interior celular. El metabolismo activo en la célula produce CO2 y H, que actúan para reducir el pH. Esto hace que el oxígeno se libere más rápidamente en un efecto conocido como efecto Bohr, que lleva el nombre de Christian Bohr, quien descubrió este fenómeno.
Un efecto adicional es la unión del compuesto 2,3 bisfosfoglicerato (2,3 BPG) que mejora la estabilidad de la desoxihemoglobina y también tiene el efecto de mover la curva de afinidad hacia la derecha, mejorando la liberación de oxígeno. |
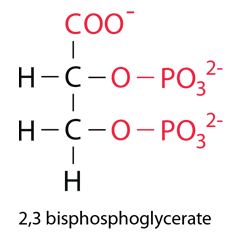 |
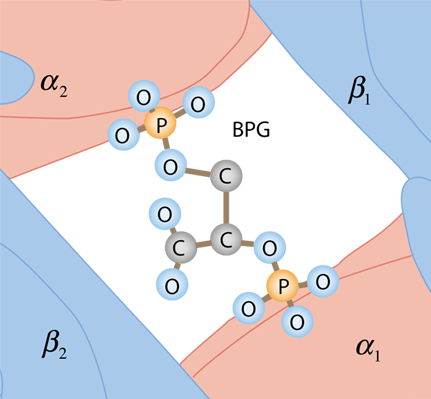 |
El BPG por las cargas superficiales de las proteínas está unido en el espacio central entre las cuatro globulinas de desoxihemoglobina. No cabe en este espacio para la oxihemoglobina, por lo que no se une. |
Conceptos de Bioquímica
Conceptos de Química
Referencias
Shipman, Wilson and Todd
Cap. 15
Matthews, van Holde, Ahern
Cap. 7
Ahern
Cap. 6
| HyperPhysics*****Química | M Olmo R Nave |