Visualización de Orbitales Electrónicos
Los bocetos de la densidad electrónica de las tres primeras capas del átomo de hidrógeno, pueden dar una impresión de las limitaciones que rigen en la construcción de la tabla periódica. Los límites de ocupación de los subniveles, surgen de los números cuánticos de los electrones atómicos y sus relaciones entre sí. Estos bocetos se derivan de las funciones de onda del hidrógeno que corresponden a la densidad de electrones.
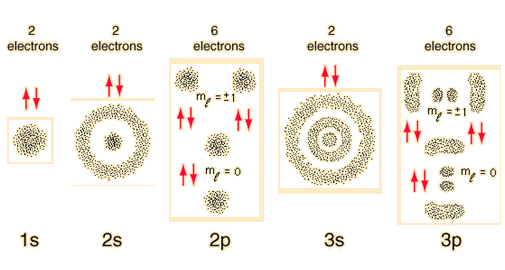
Los números de las principales capas, tal como 1s, surgen del número cuántico principal n en la descripción de la mecánica cuántica de los electrones. Las letras designan las sub-capas y siguen la notación espectroscópica histórica. En términos generales, las capas superiores tienen mayor energía (menos fuertemente unida) y están en promedio más lejos del núcleo. Esto es estrictamente cierto para el átomo de hidrógeno, donde los niveles de energía dependen sólo del número cuántico principal (se desprecia la estructura fina). Pero en átomos más grandes, la energía también depende del número cuántico orbital, por lo que los sub-niveles se llenan en el orden s, p, d, f, etc. Esta propagación finalmente conduce a una superposición, siendo el sub-nivel 4s inferior en energía al sub-nivel 3d.
La división de los electrones en capas principales, alienta una especie de "modelo planetario", y si bien esto no es del todo exacto como descripción de los electrones, tiene un cierto valor mnemotécnico para el seguimiento en la construcción de los elementos más pesados.
Quizás una manera mejor de hacer un seguimiento del proceso de construcción, sea seguir justamente el llenado de estados, haciendo hincapié en el orden de construcción, y el hecho de que los estados, son estados de energía definidos cuantificados. El principio de exclusión de Pauli limita fuertemente todo el proceso de construcción, lo que permite a un solo electrón ocupar cada estado disponible. Dado que toda la naturaleza tiende a estado de energía más bajo, los estados individuales se llenarán en orden ascendente de energía.
 |
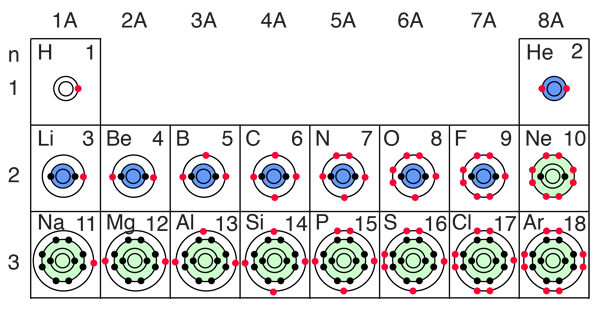
El proceso de construcción de los primeros 12 elementos de la tabla periódica da algunas pistas sobre el origen de la reactividad química. El estado espacial 1s puede tener dos estados de espín electrónico, que por lo general sólo se refieren como "spin up" y "spin down". Con dos electrones en el estado 1s, ya está lleno y es estable, formando el gas noble helio. Es químicamente no reactivo.
El litio es un metal alcalino muy activo, que tiene sólo un electrón en la segunda capa. Tiende a perder ese electrón para revertirse a la estructura electrónica del helio estable. Los elementos de la tabla periódica desde el boro al neón, están llenando el orbital 2p. Las tres posibilidades para los orbitales 2p, pueden estar asociadas con las direcciones espaciales, por ejemplo, x, y y z. El orden de llenado colocará un electrón en cada uno antes de la colocación de dos en cualquiera orbital, ya que los electrones mutuamente repulsivos prefieren estar más separados. |
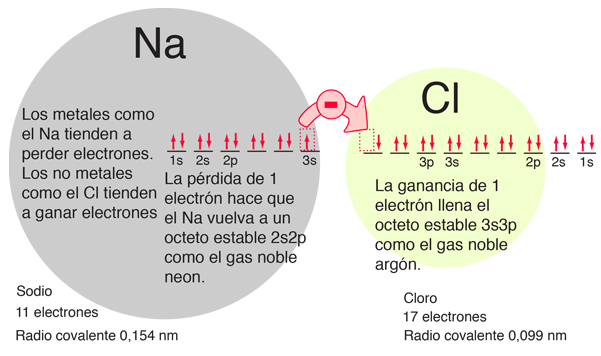
El llenado del orbital 2p coloca ocho electrones en la segunda capa, un "octeto estable". Esta configuración particularmente estable produce el gas noble neón. Pero el flúor con uno menos que un octeto estable es ¡muy activo!. Tiende a ganar un electrón, mientras que el sodio muy activo tiende a perder un electrón, produciéndose en cada caso la configuración del octeto estable del neón.
Las configuraciones orbitales de electrones proporcionan una estructura para comprender las reacciones químicas, que se guían por el principio de la búsqueda de la configuración de electrones con la energía más baja (más estable). Decimos que el sodio tiene una valencia de 1, porque tiene tendencia a perder un electrón, y el cloro tiene una valencia de -1, porque tiene tendencia a ganar un electrón. Ambos átomos son muy activos químicamente, y su combinación es el caso clásico de enlace iónico.
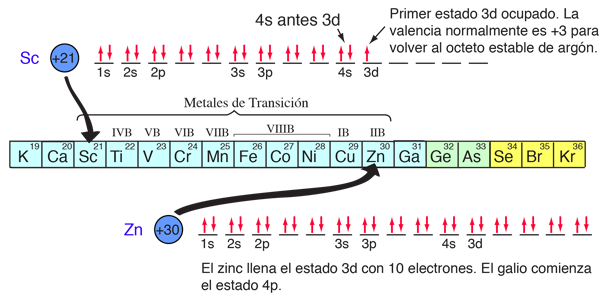
Los compuestos químicos que contienen elementos de las tres primeras filas de la tabla periódica, pueden ser bien entendidos con el tipo de consideraciones orbitales de más arriba. Las cosas se vuelven más complicadas en la cuarta fila de la tabla periódica. Los electrones 4s descienden en energía por debajo de los electrones 3d, y puesto que hay diez posibles combinaciones de números cuánticos en la sub-capa d, esto inserta 10 elementos entre los subniveles 4s y 4p, los llamados "elementos de transición".
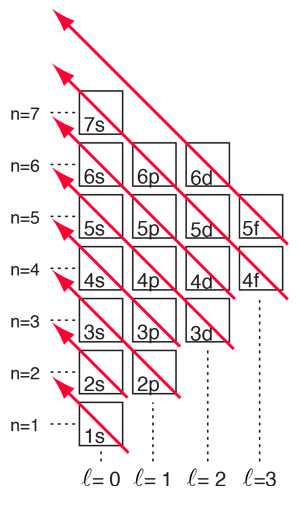 |
Con el patrón establecido anteriormente, el orden de llenado de los niveles de energía de los electrones se puede predecir en la mayoría de los casos. Aunque hay excepciones, el paso de nivel sigue el esquema indicado en el diagrama, con las flechas indicando los puntos en los que se traslada a la siguiente capa en lugar de proceder a un mayor número cuántico orbital en la misma capa. La configuración electrónica de cualquier elemento se puede encontrar haciendo clic en ese elemento en la tabla periódica. La primera excepción que se encuentra al esquema anterior es el cromo, donde se ocupa el quinto estado electrónico 3d, en lugar del segundo estado 4s. El cobre también es una excepción, llenando los diez niveles 3d, mientras está desocupado el segundo estado 4s. Estos comportamientos excepcionales del cromo y del cobre también es exhibido por los elementos justo debajo de ellos en la tabla periódica, el molibdeno y la plata. |
| Propiedades Atómicas | Energías de Ionización | Radios Atómicos |
| Tabla Periódica de los Elementos | Abundancia de Elementos, la Corteza Terrestre |
| HyperPhysics*****Química | M Olmo R Nave |