Propiedades Atómicas
Los electrones asociados en los átomos, tienen propiedades medibles que se pueden cuantizar. Los electrones se encuentran normalmente en estados de energía cuantizados, en los niveles más bajo posible para el átomo, llamado estados fundamentales. Los electrones también pueden existir en mayores "estados excitados", como lo evidencian los espectros de línea (por ejemplo el espectro del hidrógeno), que se observan cuando hacen transiciones de vuelta a los estados fundamentales. La existencia de estos estados excitados se puede demostrar de manera más directa en los experimentos de colisión, como el experimento de Franck-Hertz.
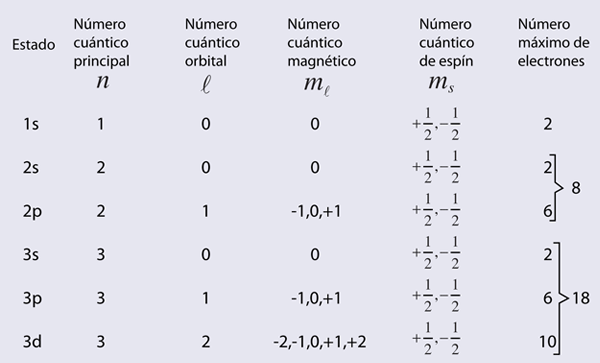
Otras propiedades asociadas con los niveles de energía de los electrones tales como. el momento angular orbital, y el espín electrónico, también se cuantifican y dan lugar a los números cuánticos utilizados para caracterizar los niveles. Estas propiedades cuantizadas están asociadas con la tabla periódica de los elementos. Los requisitos del principio de exclusión de Pauli sobre los números cuánticos, pueden ser vistos como el origen de la periodicidad. La tabla periódica proporciona un marco adecuado para la catalogación de otras propiedades físicas y químicas de los átomos.
Aunque los niveles de energía de los electrones del hidrógeno dependen solamente del número cuántico principal, los niveles de energía en otros átomos, se encuentran que tienen una fuerte dependencia del número cuántico orbital. Estos niveles muestran una menor cantidad de dependencia del momento angular total. Esta dependencia puede surgir de interacciones dentro del átomo, tales como la interacción espín-órbita o sólo pueden producirse cuando se aplican campos externos. Cuando se aplican campos magnéticos, hay un desdoblamiento de los niveles de energía atómica del efecto Zeeman, y en respuesta a los campos eléctricos, hay un desdoblamiento llamado efecto Stark.
|
Índice
Conceptos de Estructura Atómica |